
随着中国创新药研发市场的不断壮大,越来越多的新药研发公司为了增强产品和公司竞争力,开始瞄准国际市场,期望通过美国FDA的审评获得新药在美国的上市批准。
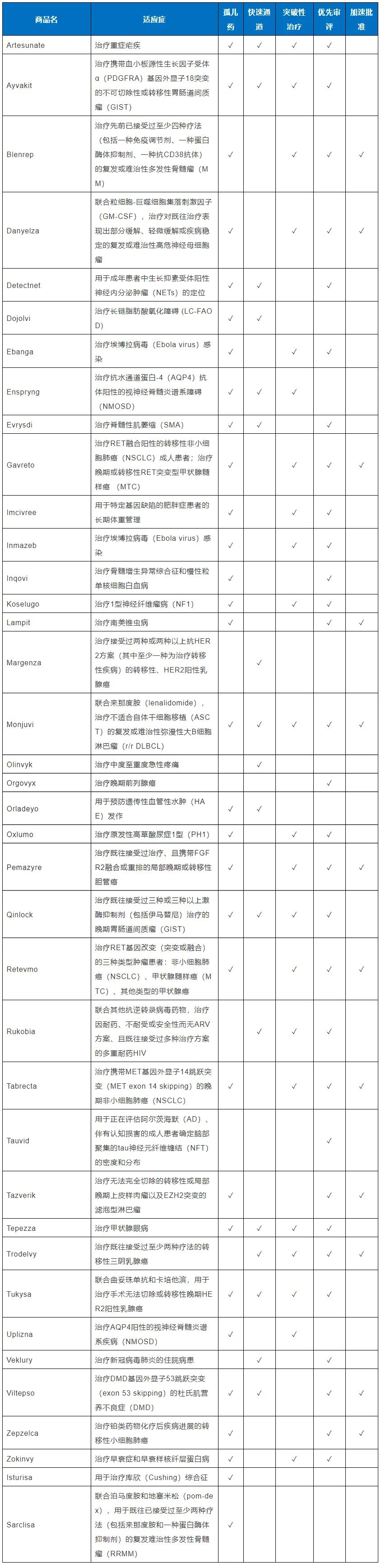
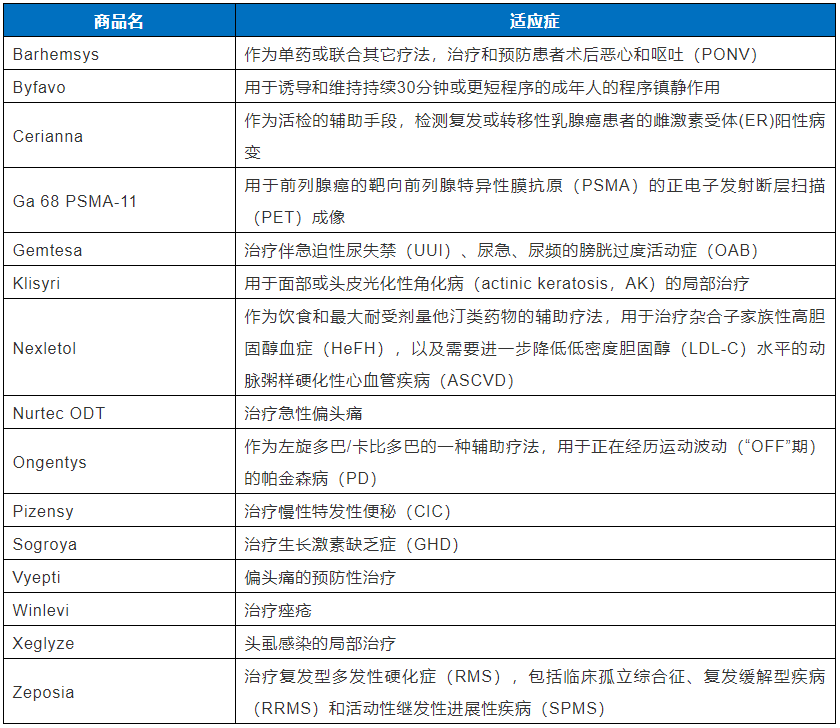
在2020年,FDA药物评价与研究中心(CDER)共批准了53个新药(详见表1 与表2),与2019年相比增加了10%(增加了5个)。在这些获批的新药中,有40个新药(占75%)是通过成功获得FDA批准后在美国实现了全球首次上市;有36个新药(占68%)借助了一种或多种FDA创新药研发与审评的加快通道。
因此,借助加快通道、充分利用FDA的政策优势以缩短研发和审评时间,为加快创新药研发实现早日上市提供了捷径。我们结合2020年获得FDA CDER批准的新药,分别简要介绍四种加快通道(即快速通道认定、突破性治疗认定、优先审评认定和加速批准)和孤儿药认定及其重要性(见表1)。

01
快速通道认定
(Fast Track Designation)
01
快速通道认定
(Fast Track Designation)
在获批的53个新药中,有17个(占32%)药物在研发早期就获得了FDA快速通道认定。当在研新药用于治疗严重疾病、并且非临床或临床数据显示有解决未满足的医疗需求的潜力时,新药研发公司可以提交快速通道认定申请。
一旦申请获得FDA批准,研发公司将会获得更多与FDA沟通交流的机会,充分讨论药物研发计划与研究数据,并且可以在递交上市申请时向FDA滚动递交新药研究资料。
02
突破性治疗认定
(Breakthrough Therapy Designation, BTD)
在获批的新药中,有22个(占42%)获得了突破性治疗认定(BTD)。获得BTD的药物是用于治疗严重疾病、并且有初步的临床证据表明该药物与现有的治疗药物相比,在一个或多个具有临床意义的终点上有实质性改善。
FDA对于获得BTD的药物有相应的政策和审评程序以提供加速研发和审评的组织保障。研发公司将会与FDA频繁的沟通交流、并获得FDA提供的技术指导,同时也可以向FDA滚动递交新药研究资料。这些政策为加快新药的后续研发提供了保障。
突破性治疗认定(Breakthrough Therapy Designation,BTD)是美国食品药品监督管理局(FDA)自2012年7月开始实施的一种新药研发与审评的加速通道,旨在加快用于治疗严重疾病的药物(包括生物制品)的研发与审评,从而尽早满足患者的治疗需求。
获得BTD的药物必须同时满足下列条件:
(1)用于治疗严重疾病;
(2)与现有治疗药物相比,有初步临床证据表明该药物单用或与一种或多种其他药物联用时,在具有临床意义的疗效指标上有显著改善。
随着中国创新药行业的不断发展壮大,尤其是经过最近5年的快速发展,许多中国制药公司在国际研发上取得了显著成绩,越来越多的制药公司获得了FDA新药临床试验(IND)许可后进入了临床研究阶段。
如何再接再厉成功获得NDA/BLA批准、实现创新药早日上市,是所有新药研发公司面临的挑战。因此,制定一个健全的国际研发策略,建立与FDA的有效沟通并充分利用加速通道(如BTD),对于一个处于临床研究阶段的新药的后续研发至关重要。成功获得突破性治疗认定对加快创新药研发有着举足轻重的作用。
获得BTD对药物研发有何益处?
与新药常规研发与审评相比,获得BTD的药物具有明显优势。FDA对于获得BTD的药物有相应的政策和审评程序以提供加速研发和审评的组织保障。研发公司将获得与FDA频繁沟通交流的机会、得到FDA提供的技术指导,并且可以在提交上市申请时向FDA滚动递交新药研究资料。这些政策为加快新药的后续研发提供了保障。
以近期抗肿瘤药物研发为例,常规的上市注册申请(NDA/BLA),从提交新药临床试验申请(IND)到上市申请(NDA/BLA)大致需要7.4年(中位数),而获得BTD的药物仅需5.2年(中位数),较前者加快了两年以上。
何时提交BTD申请?
新药研发公司可以在提交IND申请的同时,或者在IND申请递交后的任何时间向FDA提交BTD申请。FDA建议BTD申请在临床二期试验结束会议(EOP II)之前提交。通常情况下,鉴于FDA对BTD申报数据的严格要求,新药研发公司在未获得证明其研发药物优于现有治疗药物的初步临床数据之前,不建议提交BTD申请。
FDA对BTD申请的审评时限是多久?
FDA将在收到BTD申请后的60天内予以回复。
成功获得BTD后对在研项目有何影响?
在研新药一旦被FDA认定为突破性治疗,新药研发公司将获得与FDA频繁沟通交流的机会,并得到FDA对药物研发计划的建议及指导。针对获得BTD的药物,FDA制定了相应的政策与详细的管理流程,用于指导与协调其内部的审评工作,从而确保加快药物的研发与审评进程。
在整个药物研发过程中,FDA通过多次举行与新药研发公司之间的会议(Type B会议)及其他沟通方式, 加强新药研发公司与FDA高级管理人员及跨学科资深审评人员之间的交流,促进对研发药物的高效审评;同时针对药物研发过程中出现的关键问题及时向新药研发公司提出建议,以确保临床试验设计的有效性。
FDA通过与新药研发公司之间的协作与沟通交流,有效确保了研发公司获得药物审批所需的非临床与临床数据。

如何应对BTD的机遇与挑战?
虽然获得BTD可以显著缩短药物的研发时间,有助于药物早日上市,但成功获得BTD申请却并非易事。自2012 年7月BTD申请开始,截至2020年9月,FDA药物评价与研究中心(CDER)和生物制品评价与研究中心(CBER)共收到1079项申请,其中418项获得批准,521项被拒绝,121项被撤回。
该数据显示,BTD申请获得FDA认定的成功率低于40%。最新数据显示,在2020年CDER批准的53个创新药中,获得BTD的药物有22个,占获批新药的42%。
奥来恩如何帮助您成功获得BTD?
03
优先审评认定
(Priority Review Designation)
03
优先审评认定
(Priority Review Designation)
在获批的新药中,有30个(占57%)获得了FDA优先审评认定。如果FDA认为一个用于治疗严重疾病的药物在获得新药批准后,可以对这种疾病治疗的有效性与安全性提供显著改善,则会授予该药物优先审评认定。获得优先审评的新药申请(NDA/BLA),FDA会在6个月内完成审评,与标准审评时间(10个月)相比缩短了4个月。
04
加速批准
(Accelerated Approval)
04
加速批准
(Accelerated Approval)
05
孤儿药认定
(Orphan Drug Designation, ODD)
05
孤儿药认定
(Orphan Drug Designation, ODD)
孤儿药认定(ODD)是FDA审评申请资料后颁发给符合条件的药物的一种资格认定。孤儿药是指用于预防、诊断或治疗罕见病的药物(罕见病是指在美国患病人数少于20万的疾病)。
2020年FDA CDER批准的53个新药中,有31个新药(占58%)获得了孤儿药认定。获得ODD的药物可以享受政策上相对应的福利。

通过向FDA申请获得一种或多种加快通道以及孤儿药认定,是新药早日上市的重要策略之一。
奥来恩是拥有多年药政法规咨询与新药注册经验的专业团队,并且已经为许多创新药研发公司成功获得了FDA加快通道及孤儿药认定。奥来恩将会助力您的新药研发,为实现在研新药早日上市并造福病患者提供新药申报的专业支持与保障。




 个人中心
个人中心
 我是园区
我是园区




