您还不是认证园区!
赶快前去认证园区吧!
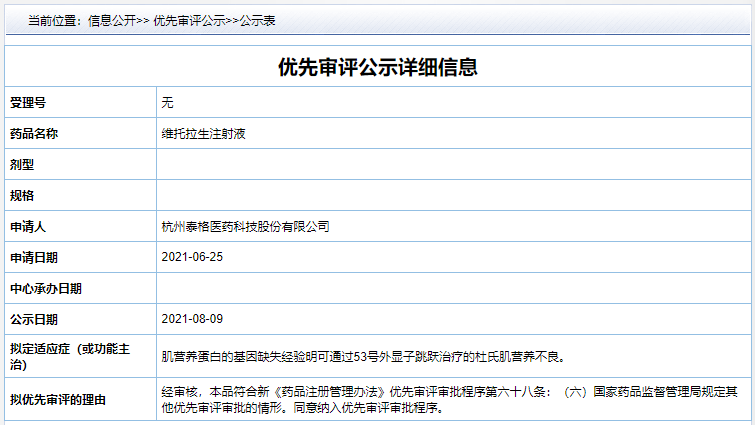
8 月 9 日,CDE 官网最新公示,拟将维托拉生注射液纳入优先审评审批,适应症为:肌营养蛋白的基因缺失经验明可通过 53 号外显子跳跃治疗的杜氏肌营养不良。
杜氏进行性肌营养不良 (Duchenne muscular dystrophy,DMD) 是最常见的 X 连锁隐性遗传性肌肉变性疾病,在男性新生儿中的发病率约为 1/3500。DMD 是由于 Xp21.2 区的抗肌萎缩蛋白基因 (dystrophin,DMD) 突变所致,患者的主要临床表现包括进行性、对称性肌无力。由于呼吸肌和心肌受累,通常在 30 岁前死亡。
维托拉生注射液是泰格医药与日本新药株式会社联合开发的一种反义寡核苷酸药物,可以靶向肌营养不良蛋白前体 mRNA,于 2020 年 3 月首次上市,用于治疗杜氏肌营养不良(DMD)。
在一项 II 期临床试验(NCT02740972)中,16 名受试者分别随机接受本品或安慰剂治疗 4 周,然后再接受 2 个不同剂量(40 mg/kg、80 mg/kg)的维托拉生开放性治疗 20 周。结果显示,维托拉生的治疗与平均抗肌萎缩蛋白表达显著增加有关,40 mg/kg 组和 80 mg/kg 组在试验前的抗萎缩蛋白平均基线水平为 0.3% 和 0.6%,试验后抗肌萎缩蛋白的平均水平分别为 5.7% 和 5.9%。
2020 年 3 月 25 日,维托拉生在日本获批上市;2020 年 8 月 12 日,在美国获批上市,此前曾获 FDA 授予的罕见儿科疾病认定、孤儿药资格以及快速通道资格。
2021 年 5 月,维托拉生注射液首次在国内申报临床,7 月 13 日获批临床。今日其上市申请拟纳入优先审评审批,意味着杜氏肌营养不良患者即将迎来一款新疗法。



 个人中心
个人中心
 我是园区
我是园区




