6 月 2 日,NMPA 最新批件显示,恒瑞医药「吡咯替尼」新适应症获批上市,联合曲妥珠单抗及多西他赛,适用于治疗表皮生长因子受体 2(HER2)阳性早期或局部晚期乳腺癌患者的新辅助治疗。此前在 2021 年 9 月,吡咯替尼这项适应症以「符合附条件批准」被纳入优先审评名单之中。点此回顾受理号详情


吡咯替尼是一种小分子、不可逆、泛 ErbB 受体酪氨酸激酶抑制剂。继 2018 年 8 月获得有条件批准上市后,吡咯替尼已于 2020 年 7 月获国家药监局完全批准。适应症为联合卡培他滨,适用于治疗 HER2 阳性、既往未接受或接受过曲妥珠单抗的复发或转移性乳腺癌患者。使用前患者应接受过蒽环类或紫杉类化疗。
恒瑞正积极将吡咯替尼推向乳腺癌各阶段治疗中,包括新辅助、一线、辅助,还在针对其他癌种开展临床。
吡咯替尼乳腺癌适应症开发历程甘特图

来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
2021 年 6 月 4 日,恒瑞宣布乳腺癌新辅助治疗 III 期临床达到了 tpCR 主要终点,取得成功。这项研究(HR-BLTN-III-NeoBC)是一项评价马来酸吡咯替尼片联合曲妥珠单抗加多西他赛对比安慰剂联合曲妥珠单抗加多西他赛术前治疗早期或局部晚期 HER2 阳性乳腺癌的有效性和安全性的随机、双盲、平行对照、多中心的 III 期临床研究(NCT03588091),由复旦大学附属肿瘤医院吴炅教授担任主要研究者,全国 17 家中心共同参与。
主要研究终点是独立评审委员会(IRC)通过病理学评估的总体病理完全缓解(tpCR),次要研究终点包括参研中心病理科医生评估的 tpCR、无事件生存时间(EFS)、无疾病生存时间(DFS)、无远处转移生存时间(DDFS)、客观缓解率(ORR)和安全性。
研究共入组 355 例受试者,按照 1:1 随机入组,分别接受吡咯替尼联合曲妥珠单抗加多西他赛治疗组(试验组)或安慰剂联合曲妥珠单抗加多西他赛治疗组(对照组),每 21 天为一个治疗周期,共 4 个周期。研究结果表明,对于早期或局部晚期 HER2 阳性乳腺癌,在多西他赛和曲妥珠单抗的基础上联用吡咯替尼的新辅助治疗能够显著提高患者的 tpCR 率。目前其临床数据尚未披露。
根据Insight 数据库,吡咯替尼目前启动了 26 项临床,其中包括 2 项 II 期临床和 6 项 III 期临床,涉及到乳腺癌、非小细胞肺癌、胆道癌、胃及胃食管交界处癌等多个癌种,并与同企业研发的创新药启动联合用药临床试验。
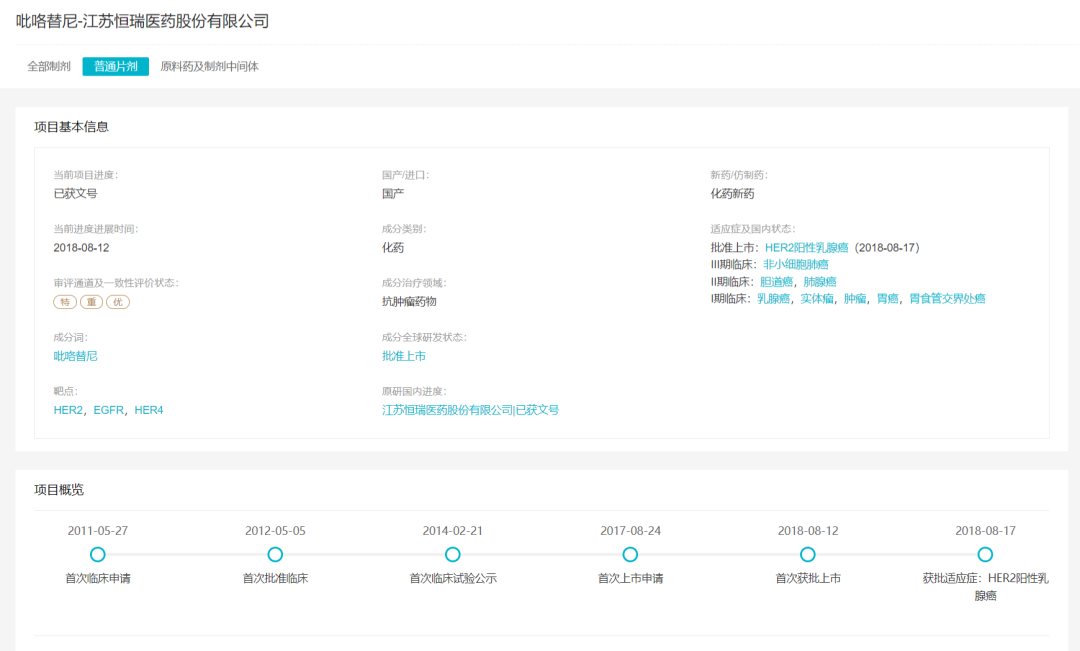
吡咯替尼项目概况(Insight)






 个人中心
个人中心
 我是园区
我是园区




