
责编 | 酶美
“动物”想要动,均需要肌肉的作用。在庞大的动物界内,不同物种肌肉细胞的大小形态区别很大 。在长达数亿年的进化中,肌细胞由最初出现时的单核逐步进化为多核,而多核肌细胞形态的出现使一些动物拥有了更强大且更灵活的肌肉组织,这极有可能增强了新物种对环境的探索适应能力并加快了动物的演化进程。我们知道多核肌细胞的出现是肌肉细胞融合的结果,然而,现阶段我们对此过程出现的原因与进程还知之甚少。
2022年9月2日,乔治亚大学(University of Georgia)的毕鹏鹏博士团队与乔治亚理工学院(Georgia Tech)的Alberto Stolfi博士团队联合在Science Advances期刊上以Article形式发表了题为Evolution of a chordate-specific mechanism for myoblast fusion的研究论文。这项研究系首次对脊索动物门中几个关键进化节点物种的肌肉细胞融合状态以及基因功能进行了系统性分析。

研究发现(图1),早期出现的脊索动物文昌鱼(lancelet),其肌肉细胞是单核的;而随后出现的脊索类物种背囊动物(tunicate),其肌肉细胞则出现了多核化,代表细胞融合的出现;再后来演化出的脊椎类物种七鳃鳗(lamprey),其肌肉细胞拥有了更多的细胞核,代表细胞融合的加强。此次研究发现这两次极其重要的发育形态的进化与Myomaker(MymK)/ Myomixer(MymX)基因的依次出现密切相关。

Myomaker与Myomixer是最近几年首先在小鼠基因组内发现并被重命名的两个基因【1-4】。它们均编码膜蛋白,且只在肌肉融合的过程中表达。在小鼠胚胎中敲除其中任何一个基因都会造成严重的肌细胞融合障碍并导致小鼠肌肉运动全部消失,例如隔膜肌功能缺陷导致小鼠无法自主呼吸,从而造成新生小鼠的死亡。本文的研究是第一次在背囊动物(属无脊椎)里发现了小鼠Myomaker的同源蛋白(26%相似度)。而十分有趣的是,Myomixer基因序列并未在任何的无脊椎物种里出现,而最早出现Myomixer基因的物种是现存最古老的脊椎动物七鳃鳗。除了位于AxLyCxL疏水域的7个氨基酸比较保守以外,此次在七鳃鳗基因组里新发现的Myomixer蛋白(全长583个氨基酸)与此前发现的所有其他高等脊椎动物的Myomixer蛋白(全长< 100个氨基酸)的序列以及长度有很大的不同 。为了准确的检测新发现同源基因的功能,研究者在人或小鼠的肌肉细胞里分别敲除了内源的Myomixer基因,然后利用七鳃鳗的Myomixer进行了营救实验,发现七鳃鳗的Myomixer能显著的促进细胞融合,证明了新发现的Myomixer基因功能的保守性。并且,与所有其他脊椎物种的Myomixer蛋白一样,七鳃鳗Myomixer蛋白的功能也完全依赖于Myomaker。
本文研究发现Myomaker在背囊动物里的表达与其肌肉细胞融合的出现在时空上呈现紧密关联,多核细胞一起勾勒出一柄如意的形状。利用CRISPR敲除背囊动物的Myomaker基因之后,肌细胞的多核化也出现了明显的障碍。在人、小鼠或者蜥蜴Myomaker基因缺失的细胞里引入背囊动物的Myomaker基因,可以有效的改善肌细胞融合,说明背囊动物与脊椎动物Myomaker基因的功能具有一定保守性。然而,与脊椎动物Myomaker截然不同的是,背囊动物的Myomaker蛋白不能与任何脊椎动物的Myomixer蛋白协同促进细胞融合。表明除了获得Myomixer的序列以外,早期脊椎动物的祖先还需要Myomaker蛋白结构发生协同进化来促使其产生与Myomixer的功能协调。

以上研究结果揭示了一个非常有趣的肌肉细胞融合进化史(图)。在大约5.4 亿年前甚至更早之前,被囊动物与脊椎动物的共同祖先通过复制Tmem8基因获得了Myomaker基因,这使得微弱的肌细胞融合首次成为可能;后来,脊椎动物的共同祖先新获得了一个孤儿基因Myomixer,它的出现可以与Myomaker协同配合从而显著的提高肌细胞的融合能力。值得一提的是,虽然节肢动物门(Arthropoda,如果蝇)的物种也像脊索动物门里的物种一样拥有肌细胞融合的能力,但Myomaker与Myomixer基因均未在节肢动物里出现,表明动物界中肌细胞融合的出现是典型的趋同进化。
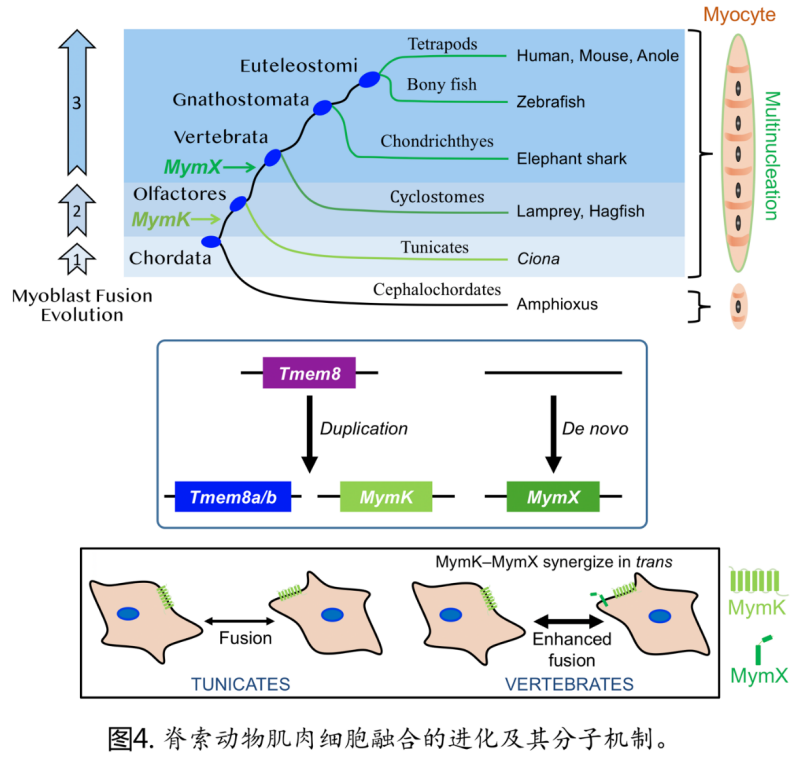
得益于上述进化方面的新发现,研究者们有机会深入探究了Myomaker与Myomixer功能配合的机制。毕鹏鹏博士团队此前的研究【5】发现为了使两个肌肉细胞融合,Myomaker 需要存在于两边,而在其中的任何一个细胞膜上加入Myomixer 蛋白都可明显的提高融合效率。由此产生了一个重要的问题,即Myomaker与Myomixer如何进行功能协同:它们是发生在两个不同的细胞间(in trans)还是同一个细胞里(in cis)?因为被囊动物的Myomaker蛋白不具备与Myomixer蛋白的功能协同性,该特性为解决 trans/cis 协同问题提供了绝佳的机会。研究者设计实验首次证明了Myomixer与Myomaker的协同是以 trans 形式发生 ,即需要两者表达在两个即将发生融合的不同细胞中。此外,通过与密歇根大学的张阳博士课题组合作,本研究首次利用人工智能预测并发现了被囊动物的Myomaker蛋白与脊椎动物的Myomaker蛋白结构上的相似性以及差异性。进一步通过比较突变体的活性,研究者发现了脊椎动物Myomaker蛋白上数个与Myomixer进行功能协同的必要位点(图5)。
综上所述,该研究利用多种模式以及非模式物种,不仅揭示了一个重要发育形态的起源与进化过程,也加深了我们对肌细胞融合分子机制的理解。
制版人:十一
参考文献
1. D. P. Millay, J. R. O’Rourke, L. B. Sutherland, S. Bezprozvannaya, J. M. Shelton, R. Bassel-Duby, E. N. Olson, Myomaker is a membrane activator of myoblast fusion and muscle formation. Nature 499, 301–305 (2013).
2. P. Bi, A. Ramirez-Martinez, H. Li, J. Cannavino, J. R. McAnally, J. M. Shelton, E. Sánchez-Ortiz, R. Bassel-Duby, E. N. Olson, Control of muscle formation by the fusogenic micropeptide Myomixer. Science 356, 323–327 (2017).
3. Q. Zhang, A. A. Vashisht, J. O’Rourke, S. Y. Corbel, R. Moran, A. Romero, L. Miraglia, J. Zhang, E. Durrant, C. Schmedt, S. C. Sampath, S. C. Sampath, The microprotein minion controls cell fusion and muscle formation. Nat. Commun. 8, (2017).
4. M. E. Quinn, Q. Goh, M. Kurosaka, D. G. Gamage, M. J. Petrany, V. Prasad, D. P. Millay, Myomerger induces fusion of non-fusogenic cells and is required for skeletal muscle development. Nat. Commun. 8, (2017).
5. H. Zhang, J. Wen, A. Bigot, J. Chen, R. Shang, V. Mouly, P. Bi, Human myotube formation is determined by MyoD-Myomixer/Myomaker axis. Sci. Adv. 6, (2020).


转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区





