

根据Checkpoint介绍,Cosibelimab是一款潜在best-in-class、高亲和力、IgG1亚型全人源PD-L1单抗,可直接与PD-L1结合,进而阻断其与PD-1以及B7.1受体相互作用,从而消除PD-L1对抗肿瘤CD8+T细胞的抑制作用,最终恢复细胞毒性T细胞介导的反应。
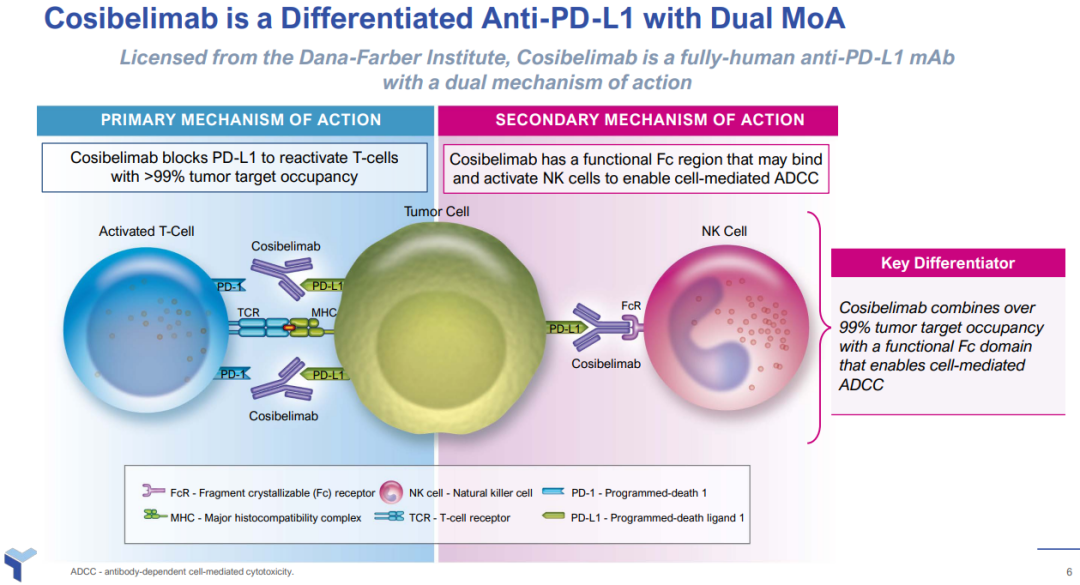
相较目前市面上销售的PD-1以及PD-L1单抗,Cosibelimab不仅可通过持续的、超过99%的目标肿瘤占位率重新激活抗肿瘤免疫反应,还能通过诱导抗体依赖性细胞介导的细胞毒性作用(ADCC)以加强抗肿瘤活性。
此次上市申请基于一项cosibelimab治疗转移性cSCC患者的注册性临床试验积极数据。结果显示,78例患者中客观缓解率(ORR)为47.4%(95% CI:36.0, 59.1),达到主要终点。其安全性与耐受性与既往披露结果一致。
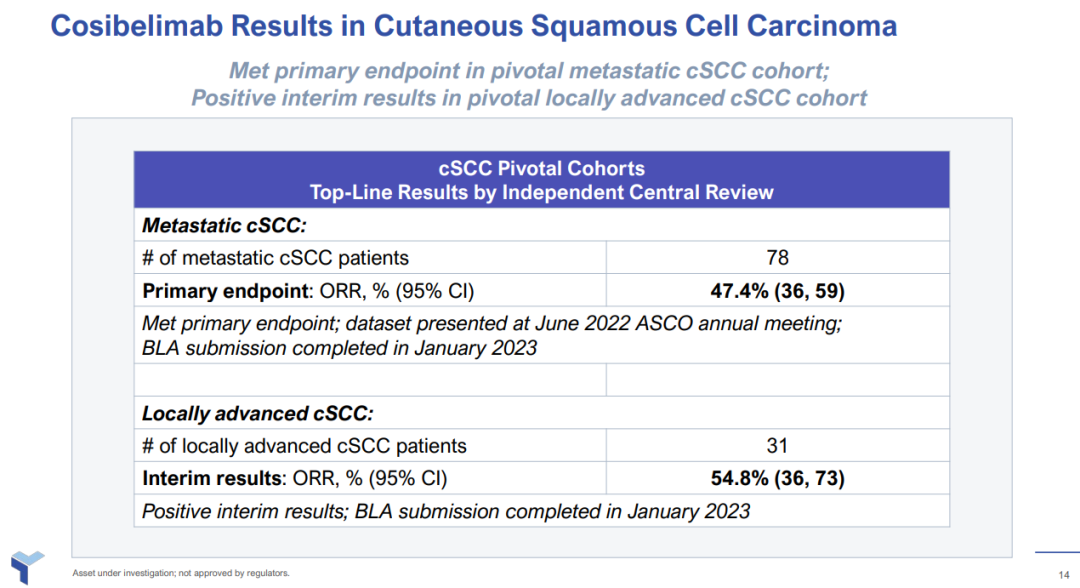
此外,cosibelimab用于晚期cSCC患者研究结果显示,31例患者中ORR达到54.8%(95% CI:36.0, 72. 7)。
cSCC是美国第二大常见的皮肤癌类型,据皮肤癌基金会估计,每年发病患者达180万例。大多该疾病患者可通过切除局部肿瘤达到治疗目的,但事实上,约4万例患者会进展至晚期,预计每年1.5万例患者因此死亡。除了危及生命,由于肿瘤通常发生在头部和颈部,易侵犯血管、神经以及眼睛或耳朵等重要器官,cSCC还会导致严重的并发症和外观畸形。
Checkpoint总裁兼首席执行官James Oliviero表示:“2021年,美国约有 11,000例cSCC患者接受了系统治疗。由于PD-1抑制剂在患者处方中占比不到一半,因此cSCC仍需更有效且耐受的疗法,尤其是针对大量患有免疫抑制或自身免疫性疾病的cSCC患者。凭借其独特的作用机制和令人信服的安全性,如果cosibelimab获得批准,将为现有疗法无法满足的患者带来新治疗选择。”




 个人中心
个人中心
 我是园区
我是园区




