Enhertu 获批 HER2 低表达乳腺癌,辉瑞 20 亿美元引进 PROTAC 国内报临床… | Insight 创新药周报
收藏
关键词:
临床新药获批创新药癌周报辉瑞药
资讯来源:Insight数据库 + 订阅账号
发布时间:
2022-08-07
据
Insight 数据库
统计,本周( 8 月 1 日 - 8 月 6 日)全球共有 44 款创新药(含改良新)研发进度推进到了新阶段,其中包括 2 款获批上市、2 款新申报上市、14 款新启动临床,16 款新获批临床。除化药之外,CAR-T 疗法最多,5 款在本周发生新进展,均处于早期研发阶段。
下面,Insight 将分别摘取国内外部分重点项目做介绍。
国内方面,本周共有 38 款创新药研发进度推进到了新的阶段,研发后期产品 2 款新申报上市,1 款进入 III 期临床;早期阶段 8 款新申报临床,14 款新获批临床,10 款新启动临床。
8 月 4 日,据 CDE 官网显示,罗氏眼科双抗 Faricimab 注射液的上市申请获受理
(受理号:JXSS2200030)。
来自:Insight 数据库网页版(点击放大,可查看大图)
Faricimab 是一款靶向 VEGF 和 Ang-2 的眼内治疗药物,这 2 种途径可驱动多种视网膜疾病,包括 nAMD 和 DME。VEGF 和
Ang-2
通过破坏血管稳定性、导致新的渗漏血管形成、并增加炎症反应,从而导致视力下降。而 Faricimab 可同时强效、特异性地结合并抑制这两种途径。
2022 年 1 月,Faricimab 首次获美国 FDA 批准上市,用于治疗糖尿病性黄斑水肿(DME)和湿性年龄相关性黄斑变性(nAMD),成为首款用于治疗眼科疾病的双抗,商品名为 Vabysmo。
约 2 个月后,该药在日本获批上市。本周,又在中国递交了上市申请。
来自:Insight 数据库网页版(点击放大,可查看大图)
在国内,Faricimab 于 2019 年 5 月首次获批临床,同年 7 月首次启动临床。目前在 CDE 临床试验共登记有 5 项 III 期临床研究。
8 月 5 日,信立泰药业的 SAL0112 片首次获批临床
(受理号:CXHL2200342/3/4)。这是一款胰高血糖素样肽-1 受体(GLP-1R)的口服小分子偏向激动剂,针对 2 型糖尿病(T2DM)。
据 Insight 数据库显示,除 2 型糖尿病之外,SAL0112 还针对多种代谢病进行开发。另有一项临床申请正在审评当中,用于成人肥胖患者或伴发一种及以上与体重相关危险因素的超重患者的体重管理(受理号:CXHL2200366/7/8);此外该药潜在还有望用于其他糖尿病并发症的治疗。
激动 GLP-1R 可以促进胰岛 β 细胞的增殖,血糖依赖型刺激胰岛素的合成与释放,并抑制胰高血糖素的合成与释放,低血糖风险较低;可以抑制胃液分泌和胃肠道的蠕动,延迟胃的排空,增加饱食感,减少食物摄取。此外,激动 GLP-1R 可以提升心血管的功能,抑制心肌细胞的凋亡,可以抑制肾脏的氧化应激和炎症反应,抑制糖基化终产物等,从而产生保护肾脏的作用,因此,GLP-1R 激动剂可应用于 2 型糖尿病和肥胖,同时伴有心肾的获益。
目前,国内已上市的 GLP-1RA 均为肽类注射剂(如利拉鲁肽注射液、司美格鲁肽注射液、度拉糖肽注射液等),长期频繁注射或存在患者依从性较差等问题。
而 SAL0112 片作为口服的 GLP-1R 的偏向激动剂
,不仅具有与和多肽类 GLP-1RA 相似的药理作用,且有望改善 2 型糖尿病的给药途径,提高患者用药便利性,增强用药依从性。
此外,作为小分子药物,SAL0112 片预期或将比口服多肽类药物更能提高生物利用度,受饮食、合并用药等因素的干扰更小,具有较大开发潜力。
不过据 Insight 数据库显示,诺和诺德已经在国内递交司美格鲁肽片剂上市申请,将成为国内首款上市的口服 GLP-1RA;此外,国内另有 3 家企业在开发小分子药物。其中进展最快的是华东医药引进的 TTP273,2020 年度已经启动 II 期临床。此外,辉瑞的进口 GLP-1 小分子 Danuglipron 也启动了 I 期临床,恒瑞的 SHR-2042 自 2018 年获批临床后,尚未启动临床。
8 月 3 日,天士力的 PD-L1/VEGF 双抗 B1962(AP-505)获批临床(受理号:CXSL2200226)。这是 2019 年 7 月天士力与 AP Bio 签订协议获得的项目。
据天士力招股书,作为一款 PD-L1/VEGF 双抗,B1962 既可阻断 PD-1 和 PD-L1 的结合,恢复 T 细胞功能,使免疫系统能够杀伤肿瘤细胞;又可阻断 VEGF 和 VEGFR 结合,使肿瘤血管退化,使存活血管正常化,持续抑制新生和再生血管生长,从而对肿瘤进行控制和治疗,还可靶向肿瘤部位,清除肿瘤内血管表皮生长因子,有效抑制肿瘤部位的新生血管生长,与 VEGF (Avastin)联合用药的预期药效更好。
B1962 采用高表达细胞株高效筛选技术,产品产量高达 6g/L 以上,有望大幅提高产能、降低生产成本,形成竞争优势。
两家公司合作的产品还包括 PD-1/OX40 双特异性抗体 B1961(AP201)、4-1BB 单抗 B1963(AP116),当前尚属于临床前开发阶段。
8 月 3 日,上海睿跃生物(Cullgen)的 TRK 蛋白靶向降解药物 CG001419 片获批临床,治疗 NTRK 基因融合、NTRK 基因点突变和 NTRK 基因扩增或过表达晚期/转移性成人实体瘤(受理号:CXHL2200331/2)。这是全球首款也是唯一一款靶向 TRK 的 PROTAC 药物。
睿跃生物
是一家新兴的生物制药公司,致力于开发全球首创的靶向蛋白降解剂药物,以用于治疗癌症和其它缺乏有效疗法的严重疾病。公司拥有专有技术平台 uSMITE™(ubiquitin-mediated, small molecule-induced target elimination technology)。睿跃生物的 uSMITE™ 除了抑制靶点蛋白的功能外,通过利用泛素蛋白酶体系统将药物设计扩展到一个全新的方向,使靶向消除「不可成药」的酶和其它蛋白质成为可能。
神经营养受体酪氨酸激酶(Neurotrophin receptor kinase,NTRK)是一类神经生长因子受体,与细胞增殖、分化、代谢和凋亡有密切的关系,研究表明,当染色体变异发生 NTRK 基因融合,可导致 TRK 激酶下游信号过度激活,进而可导致癌症产生。
NTRK 基因融合可见于多种实体瘤类型中,包括胰腺癌、甲状腺癌、唾液腺癌、乳腺癌、结直肠癌、肺癌等,尤其在一些罕见的癌症,如婴儿纤维肉瘤、类似乳腺分泌性癌、乳腺分泌型癌中,NTRK 基因融合的发生率可达 90% 以上。因此,针对其开发的靶向降解药物有望拥有泛癌种治疗潜力。
辉瑞超 20 亿美元引进!ER 靶向 PROTAC 国内申报临床
8 月 4 日,辉瑞引进的 ER 靶向口服 PROTAC 新药 ARV-471(辉瑞代号:PF-07850327)首次在中国申报临床。
这是全球进展最快的一款 PROTAC 药物,由该领域先驱 Arvinas 公司开发。辉瑞在去年 7 月以
6.5 亿美元预付款 + 潜在高达 14 亿美元的里程碑付款
达成战略性全球合作,将其收入囊中。
据 Insight 数据库显示,该药的临床开发始于 2019 年 8 月。首项 I/II 期临床在 ER 阳性、HER2 阴性乳腺癌末线患者中评估 ARV-471 单药或联合 CDK4/6 抑制剂哌柏西利的安全性、PK/PD 及初步抗肿瘤活性
。临床数据已经陆续披露。
ARV-471 临床开发历程(截至 2022.8.4)
来自:
Insight 数据库网页版
(http
://db.dxy.cn/v5/home/)
入组患者既往接受过 CDK4/6 抑制剂治疗,80% 接受过氟维司群治疗,78% 接受过既往化疗。疗效方面,ARV-471 在 CDK4/6 抑制剂预处理的患者中显示出抗肿瘤活性,47 名入组患者的临床受益率 (CBR) 为 40%;在 38 名患者中,3 名患者表现出确认的部分反应 (PR),14 名患者仍在持续接受治疗,其中 2 名患者持续治疗超过 18 个月。在所有剂量中都可见 89% 的 ER 降解。
安全性方面,ARV-471 继续表现出良好的耐受性,尚未观察到剂量限值毒性(DLT)。
ARV-471 在去年 12 月公布的 I 期临床初步数据
据 Ins
ight 数据库显示,全球靶向降解 ER 的 6 个 PROTAC 项目中,当前仅 2 个进入临床开发,除了 ARV-471 以外,还有 AI 公司冰洲石生物的
AC0682
。另外,恒瑞也开发了 ER 靶向 PROTAC。
本周境外共
有 16 款新药(含改良新)研发进度推进到新阶段
。阿斯利康/第一三共 HER2 ADC 重磅药物 Enhertu 是本周最闪耀的明星,针对 HER2 低表达乳腺癌适应症受理后不到两周就被 FDA 光速批准;此外,本周多项临床失败动态,以及各大企业的半年报发布也值得关注。
Enhertu 获美国 FDA 批准用于 HER2 低表达乳腺癌
8 月 5 日,美国 FDA 批准第一三共/阿斯利康 Enhertu(T-Dxd,DS-8201)新适应症,用于治疗先前接受过一次前线治疗的不可切除或转移性 HER2 低表达(IHC 1+ 或 IHC2+/ISH 阴性)乳腺癌患者。
7 月 25 日,阿斯利康和第一三共才刚刚宣布该项新适应症上市申请(sBLA)获 FDA 受理并授予优先审评资格,PDUFA 决定日期在 2022 年 Q4。然而这项 sBLA 仅在受理两个星期内就获得批准,早于预计审批日期 4 个月。
Enhertu 的获批重新定义了晚期/转移性乳腺癌的 HER2 表达亚型,使 HER2 表达更低的患者群体得以区分于其他 HER2 阴性群体,也能从抗 HER2 治疗当中获益。
据 Insight 数据库显示,在 6 月 22 日和 27 日,两家公司也已经分别向欧盟 EMA 和日本 PMDA 递交了 HER2 低表达乳腺癌适应症上市申请,而在中国,Enhertu 治疗 HER2 阳性乳腺癌的上市申请正在审评审批中,针对 HER2 低表达乳腺癌亦有 2 项 III 期临床在进行。
Enhertu 针对 HER2 低表达乳腺癌的适应症开发甘特图
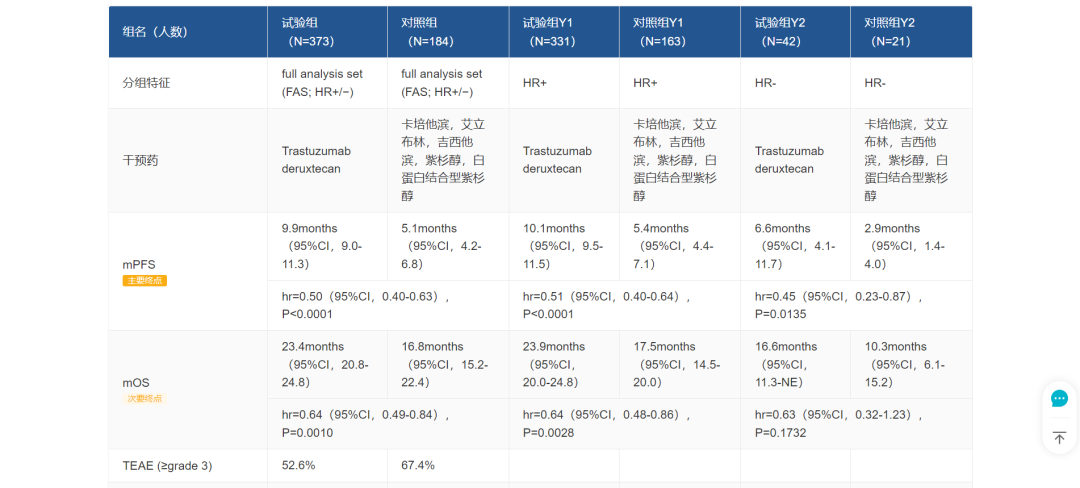
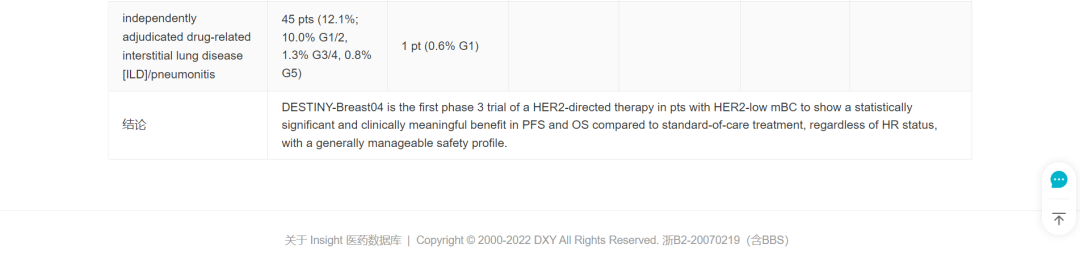
这项批准是基于 2022 ASCO 中刚刚发布结果的 DESTINY-Breast04 研究(简称 DB04),其临床数据如下(图片可放大查看):
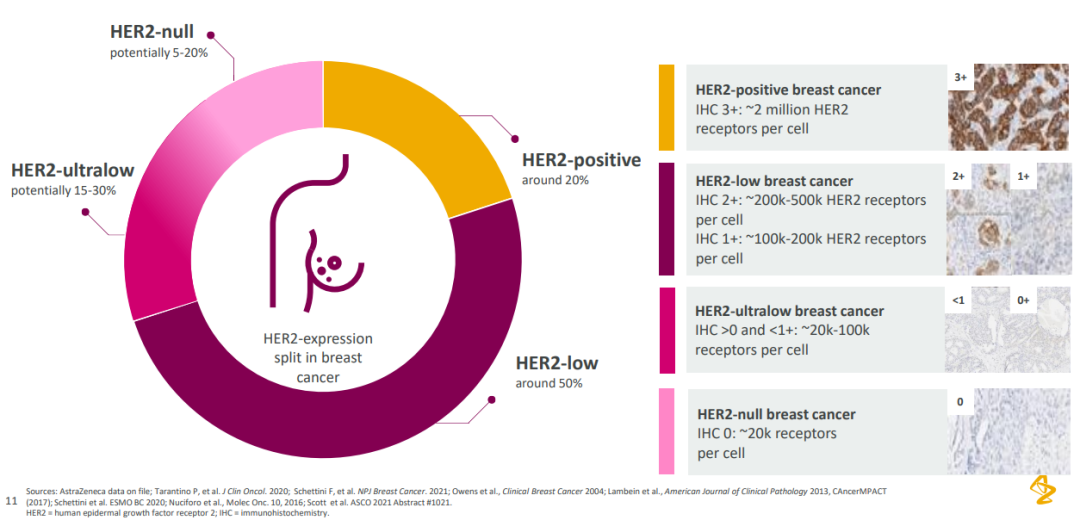
据阿斯利康资料,在乳腺癌患者中约 20% 患者为 HER2 阳性(IHC 3+),50% 的患者为 HER2 低表达(IHC 2+/IHC 1+),15-30% 的患者 HER2 极低表达(0 < IHC < 1+),5 - 20% 的患者为 HER2 阴性。
以往的 HER2 标准疗法仅能覆盖到 HER2 阳性患者,而 Enhertu 将适应症拓展到 HER2 低表达人群之后,意味着乳腺癌领域约 50% 此前不能在 HER2 靶向疗法中获益的患者从此有了新的治疗方案,这不仅对患者而言是一大福音,对企业而言也获得了更大的市场空间。
药企半年报新发布,百济神州表现亮眼,信达获赛诺菲超 6 亿欧元押注
和过去两周一样,本周同样是药企半年报发布的高峰期。可查看 Insight 本周跟进报道:
此外,多项临床失利信息也值得关注,包括默沙东 K 药相关的两项临床试验、下一代 CDK 抑制剂项目的终止、阿斯利康合作的 NKG2A 抗体 Monalizumab 等:
免责声明:
本文仅作消息分享,
并不构成投资建议,也不代表 Insight 数据库的立场,文章观点仅供分享行业见解,请广大投资者谨慎。
投稿:微信 insightxb;邮箱 insight@dxy.cn
免费试用 Insight 数据库




















 药选址
药选址





















