
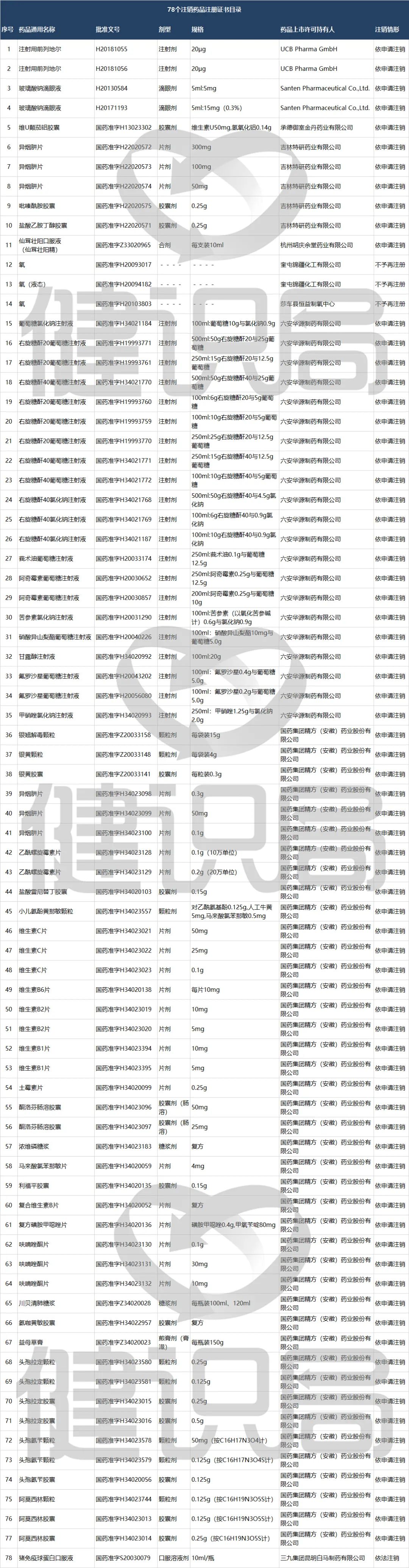
9月8日,国家药监局发布通知称,决定注销注射用前列地尔等78个药品注册证书。
健识局梳理发现,优时比的注射用前列地尔、参天制药的玻璃酸钠滴眼液、国药集团的阿莫西林胶囊、头孢拉定胶囊、头孢氨苄颗粒以及三九集团的猪免疫球蛋白口服液等78个临床常用药。
在这一批78个临床常用药品中,74个药品依申请注销,3个不予再注册和1个依法注销。其中,有两家药企注销的药品批文数量最多,他们分别是六安华源制药注销的药品批文数量达21个,国药集团精方(安徽)药业注销的药品批文数量达42个。
据新版《药品注册管理办法》规定,药品注册证书有效期为五年,药品注册证书有效期内持有人应当持续保证上市药品的安全性、有效性和质量可控性,并在有效期届满前六个月申请药品再注册。
如果到期不注册就由国家药监局注销,不得再生产这些药品,且在注销公告生效开始也不得在市场上流通。业内普遍认为,这78个药品将主动选择退出市场。

市场已趋于饱和
300个品种已主动申请撤销
健识局梳理发现,此次企业主动申请注销的78个品种尽管是临床常见品种,但同类药品批文也过度重复。以“注射用前列地尔”为例,仅国产药品就有41个药品批文,而维生素C的批文数量高达2378个。
显然,这些过度重复药品,在当下强调“创新”与“仿制药一致性评价”的改革进程中,必将遭到市场的淘汰。此前,国务院曾发文,要求严格控制市场供大于求、低水平重复、生产工艺落后的仿制药的生产和审批。
这也就意味着,今后将有更多的重复申报品种的企业会选择退出。根据现行《药品注册管理办法》,注销药品批准证明文件一共分为六种情况:
批准证明文件的有效期未满,申请人自行提出注销药品批准文号的;
按照本办法第一百二十六条的规定不予再注册的;
《药品生产许可证》被依法吊销或者缴销的;
按照《药品管理法》第四十二条和《药品管理法实施条例》第四十一条的规定,对不良反应大或者其他原因危害人体健康的药品,撤销批准证明文件的;
依法作出撤销药品批准证明文件的行政处罚决定的;
其他依法应当撤销或者撤回药品批准证明文件的情形。
事实上,每年都有因自身业务发展,药企主动申请撤销仍在有效期内的药品批文。据健识局的不完全统计,自2016年至今,至少有300个品种已主动申请撤销。有分析人士指出,随着一致性评价等政策的落地,今后将有越来越多的仿制药品种退出市场。
不可否认的是,过度重复药品市场需求已经饱和或者接近饱和,相关企业再投入大量的精力在市场上厮杀,不如转型研发创新或能在市场中立于不败。
截至目前,未过一致性评价的仿制药在多省市均已暂停挂网,业内预计,今后将有大批仿制药面临消失,90%的品种或将消失。

上市审批进入新阶段
大批“僵尸批文”将被清除
事实上,今后大批“僵尸批文”将被清除。
今年7月,国家药监局发布三个重磅文件——《突破性治疗药物审评工作程序(试行)》、《药品附条件批准上市申请审评审批工作程序(试行)》以及《药品上市许可优先审评审批工作程序(试行)》。这一系列文件的公布,也意味着中国药品上市审批已经进入新的阶段。
截至目前,全国约有18.9万药品批文,仿制药占到了95%左右。另据国家药监局2016年以来发布的至少六批过度重复药品提示信息看,部分品种批文数量甚至过千,涉及数百家药企。
在中国药品批文繁多的背后,低水平重复问题一直饱受诟病。
据健识局了解,国内药企一般只是生产几款主打品种,其他大部分批文都是闲置。业内普遍认为,随着制药工艺的不断发展,药品新老剂型更迭,再加上临床治疗方案的不断推陈出新,一些老药自然停用。
近年来,国家对于过度重复的药品批文加强监控和监管,大量品种批文过度,重复品种再申报收紧,“僵尸批文”面临清理。
按照我国现行的法规,任何药品一旦获得了批准文号后,其各个生产流程都必须固定并且在国家食药监局,倘若稍有变化也必须上报监管部门,获得批准允许后方可再投入生产。
如相关部门发现私自更改工艺就可能对药品质量存在影响,生产出的药品也属于假药,是不允许上市销售的,同时企业将会被吊销许可证一旦药品被吊销许可证,其拥有的药品批文也会被注销。
此外,药品安全问题、一致性评价政策等也是不少药品批文注销的原因。可以预见的是,在未来几年,随着多重因素的不断叠加,今后将有大批药品批文消失。





 个人中心
个人中心
 我是园区
我是园区




