
近日,Oncopeptides公司开发的多肽偶联药物(peptide drug conjugate,PDC)melflufen在美国获批上市,引发了一波PDC的关注热潮。
化疗是癌症的重要治疗手段之一。但是化疗药物对肿瘤细胞和正常细胞无特异识别功能,会导致严重的全身系统性毒性。因此,科学家们开发一类偶联药物,即将能特异性识别肿瘤靶点的配体,例如抗体作为“弹头”,与化疗药物偶联结合,精准递送至疾病部位,减少对健康组织的毒性损伤。
偶联药物中,抗体偶联药物(ADC)是近年来的研究热门,全球已有11款ADC批准上市。此外,还开发出一系列偶联药物衍生品,例如多肽偶联药物(PDC)、抗体细胞偶联药物(ACC)、病毒样药物偶联物(VDC)、抗体片段偶联药物(FDC)、抗体寡核苷酸偶联物(AOC)、抗体免疫刺激偶联物(ISAC)、抗体生物聚合物偶联物(ABC)等。
据不完全统计,国内已有四家公司投身PDC药物的研发中,其中盛诺基医药开发的SNG1005已经进展到了III期临床。
目前国内市场ADC研发扎堆,PDC却鲜有公司投入研发。或许投身多肽偶联药物(PDC)的研发,对企业来说能够实现弯道超车的机会。
PDC的技术特色
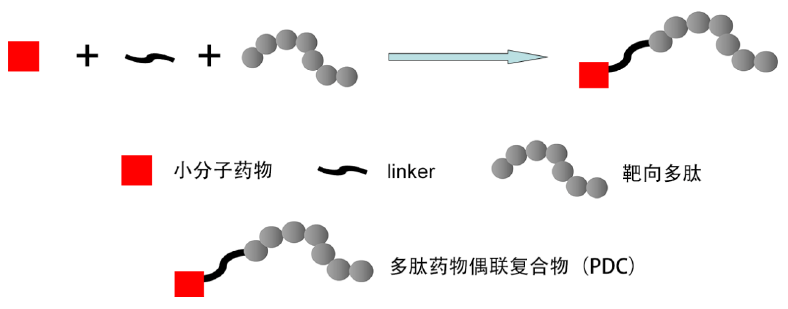
简单来说,PDC就是多肽药和化疗药的组合疗法,结合了多肽药的选择性、和化疗药的杀伤性。作用机制与抗体偶联药物(ADC)类似,但与ADC相比有独特的优势。

凭借分子量小、肿瘤穿透性强等特点,PDC更容易在实体瘤中发挥作用。相比较而言,ADC由于抗体的分子量较大,限制了穿透实体肿瘤的能力。近年来ADC获批的适应症大多是针对血液恶性肿瘤,实体瘤中较多的只有乳腺癌。
不仅如此,PDC的细胞毒性药物选择面更广泛。由于较强的肿瘤组织渗透性,PDC药物能够在靶标处累积达到高浓度,从而高效地杀伤肿瘤细胞。因此PDC可以选择阿霉素、紫杉醇等毒性相对较低且普遍应用于临床的化疗药物,作为PDC的毒性弹头,载药量也更高。
而ADC虽可以利用抗体的精准靶向,将“有毒弹头”选择性递送至癌细胞。但受抗体大分子的限制,在肿瘤组织的渗透率极低,只能选择高毒性的化疗药物,例如赫赛莱的化疗药物DM1、维布妥昔单抗的细胞毒剂单甲基阿司他丁E(MMAE),才能保证在低剂量下的肿瘤杀伤效果。
此外,PDC药物的设计与生产上更为简单,成本也较低。然而小分子量的PDC也给药物设计带来一定难度。
首先是稳定性较差。PDC的分子量远小于肾小球的过滤阈值(60 kDa),导致容易被肾脏快速清除,使细胞毒素无法在药理部位达到有效积累。因此,需要对PDC进行进一步的蛋白质工程技术改造或化学修饰,提高PDC在人体内的稳定、延长半衰期。
同时与单抗相比,多肽的组织特异性以及肿瘤靶向性稍有逊色,给靶向肽的筛选增加不小难度。可见,研发出具有靶向功能的穿透肽技术,提高靶向肽的细胞穿透能力和稳定性是PDC 目前亟需解决的主要问题。
全球有2款PDC药物上市
目前PDC领域尚处于开发的洼地,国内研究公司并不多见。全球也仅有2款PDC药物上市,分别是2018年获批的Lutathera,以及近期获得FDA加速批准的melflufen,由Oncopeptipes公司开发。

Lutathera由诺华子公司Advanced Accelerator Applications S.A开发上市,是第一款肽受体放射性核素治疗(PRRT)药物。
Melflufen的加速获批是得益于一项关键II期HORIZON的临床结果。试验纳入157例患者与地塞米松联用,治疗复发/难治性多发性骨髓瘤(MM),总缓解率达到23.7%,中位缓解持续时间为4.2个月。
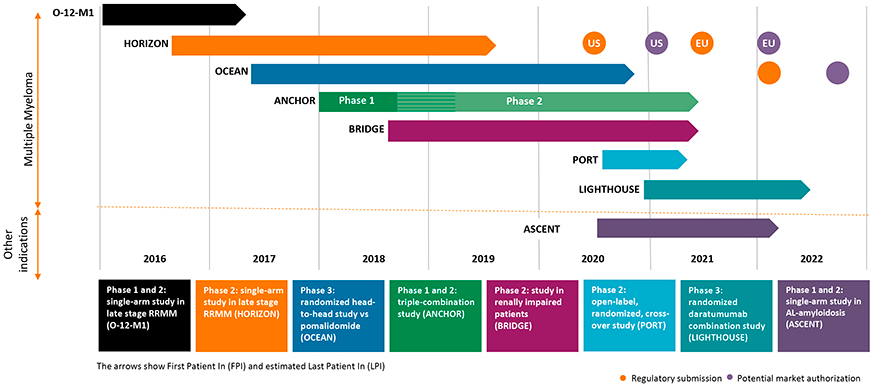
Oncopeptipes公司还在进一步开展治疗MM的III期临床试验,以补充更多的临床数据。除了多发性骨髓瘤外,Oncopeptipes还在探索melflufen的更多治疗可能性,例如用于淀粉样变性病的治疗。
此外,Oncopeptipes公司还在开发第二款PDC产品OPD5,已经获得了FDA的临床批准。
国外已有7款产品进入临床
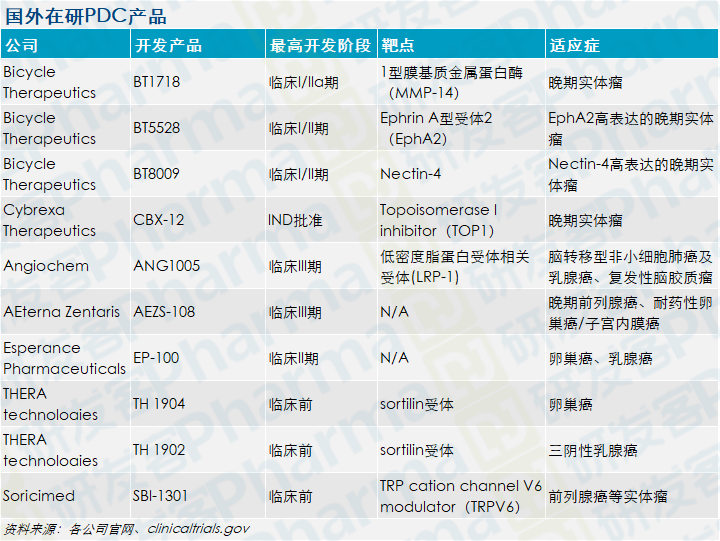
Bicycle Therapeutics公司有三款PDC在研产品,分别是BT1718、BT5528 和BT8009,均处在临床I/II期开发阶段。

Bicycle Therapeutics三款在研PDC药物
提高多肽稳定性的方法之一是环化技术。如Bicycle公司名称一样,该公司将PDC药物中的多肽设计成Bicycle,以稳定的双环肽分子结构与靶蛋白结合,达到与抗体类似的高亲和力和靶向选择性。
而Cybrexa公司的CBX-12,是依托alphalex™技术平台开发而来。该技术由pHLIP®肽、连接子和小分子抗癌剂组成,其中pHLIP®肽最早由耶鲁大学和罗德岛大学开发,并独家授权给pHLIP,后Cybrexa与pHLIP形成合作伙伴关系,拥有pHLIP®肽的全球独家开发和商业化权利。
目前CBX-12已经获得了FDA的IND批准,预计将在2021年4月启动治疗晚期实体瘤的临床试验。
其他的PDC产品,例如已进展到临床II期的AEZS-108和EP-100,从其公司官网信息中,未见公布进一步的开发进展。
国内已有产品进入III期临床
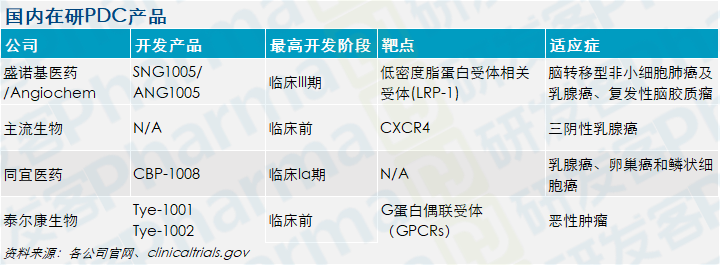
目前Angiochem已完成了II期临床,结果显示,SNG1005在治疗乳腺癌脑软膜转移癌和复发性乳腺癌脑实质转移癌中,都显示出积极的临床治疗效果。其中在对乳腺癌脑转移患者颅内和颅外的治疗中,SNG1005的临床获益率分别达到了77%和86%。
其他布局PDC产品的公司都是初创公司。其中同宜医药凭借核心技术平台BESTTM,开发出一系列抗肿瘤偶联药物(XDC)。其中以双靶向-配体偶联体CBP-1008进展最快,目前正在进行Ia期临床试验。

同宜医药产品管线 来源|同宜医药官微
泰尔康生物和主流生物的PDC产品还都在临床前。泰尔康生物主要开发以GPCRs为靶点的PDC类药物,目前正在寻求天使轮融资,用以支持Tye-1001和Tye-1002两款产品的临床开发。
主流生物医药公司也率先布局了PDC赛道,开发靶向CXCR4的多肽偶联药物。公司总裁李风翔在2020 Think Big生物医药创新项目路演活动上介绍,主打产品MB1707有望在今年启动中美临床试验,另一款产品MB010主要拓展和PD-1/ PD-L1联合用药的治疗方案。



 个人中心
个人中心
 我是园区
我是园区




