
在真核细胞中,转座子富集的异染色质通常被高度浓缩,形成核斑点结构并分布于细胞核边缘;而基因富集的常染色质则松散分布于核内,并占据核内绝大部分的体积,这种松散的分布结构有助于转录复合体的结合和促进基因的表达。浓缩的染色质通常涉及转录的抑制,比如异染色质的浓缩抑制了转座子的活性,保障了基因组的稳定。在特定发育阶段和细胞类型中,基因表达也可以通过常染色质的浓缩而被抑制。有趣的是,并不是所有浓缩的染色质都意味着转录抑制,因为很多有转录活性的细胞有着很小的细胞核,其中的分子机制却异常神秘。
精子发生是动植物有性生殖的重要环节,虽然不同物种中精细胞形态不尽相同,但各个物种中精子的染色质均被高度浓缩,以便在后期的精细胞竞争中获取优势。大多数动物和一些古老的植物类群
(如苔藓、蕨类等非种子植物)
的精子均具有可游动的尾巴,同时精细胞中会大量表达一种小的富含精氨酸的组蛋白替代物
(精蛋白,Protamines)
替换经典的核小体组分,进而达到浓缩精细胞染色质的目的
【1,2】
。缩小的精核增强了精子的游动竞争力,但是Protamines带来的染色质浓缩抑制了精子细胞里的转录。与动物及低等植物不同,开花植物的精子并不能游动,而是在花粉管中被运输到雌性生殖器官完成受精。开花植物的精子转录活跃,并且不表达精蛋白,其染色质浓缩机制一直是一个谜题。
近期,英国约翰英纳斯中心
(John Innes Centre)
冯小琦
实验室与清华大学李丕龙实验室合作,在Nature发表了标题为
Histone H2B.8 compacts flowering plant sperm via chromatin phase separation
的研究论文,文中
发现了一种全新的不影响转录的染色质浓缩机制
。作者
发现了一种在开花植物精细胞中特异性表达的组蛋白H2B变体H2B.8,它可以特异性得结合到常染色质转座子和基因间区域上,通过相分离凝缩精细胞中不转录的区域,进而在不影响基因表达的情况下达到浓缩精细胞染色质的目的。
作者首先利用超高分
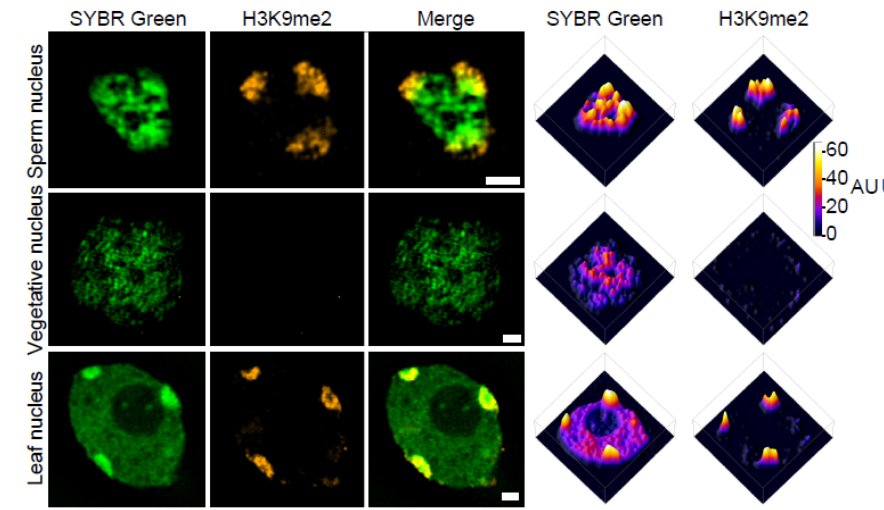
辨率显微技术(3D structured illumination microscopy,3D-SIM)观察拟南芥精子染色质结构,发现精子的异染色质和体细胞异染色质相比,表现出一定程度的去浓缩,但总体上仍形成核斑点结构,表明仍然处于较为浓缩的状态;然而,精子的常染色质区有别于体细胞和花粉营养核,表现为显著的核内不均匀分布和浓缩(Fig. 1)。
Fig. 1. 免疫荧光结合3D-SIM观察精子染色质浓缩。
为了鉴定负责精子常染色质浓缩的因子,作者使用荧光激活的细胞分选技术
(Fluorescent-activated cell sorting,FACS)
从花粉中分离了高纯度的精子细胞核和营养核,利用质谱分析,作者鉴定到了一个精细胞特异性表达的组蛋白变体H2B.8。该基因敲除后,精细胞核变大,常染色质发生去浓缩;且自身启动子驱动的H2B.8-GFP或H2B.8-Myc融合基因能够互补突变体表型
(Fig. 2a,b)
。说明组蛋白变体H2B.8负责了精细胞常染色质的浓缩。相反,如果在体细胞中异位表达H2B.8会使常染色质发生凝缩,使细胞核变小,表明H2B.8对于常染色质浓缩和细胞核变小是充分的,其功能不依赖精子特异的因子
(Fig. 2c,d)
。
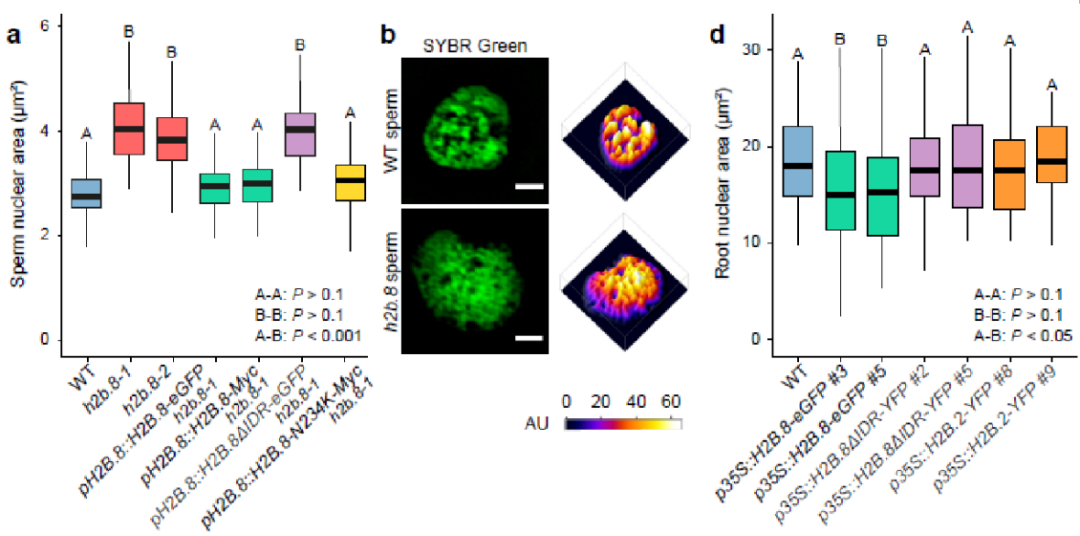
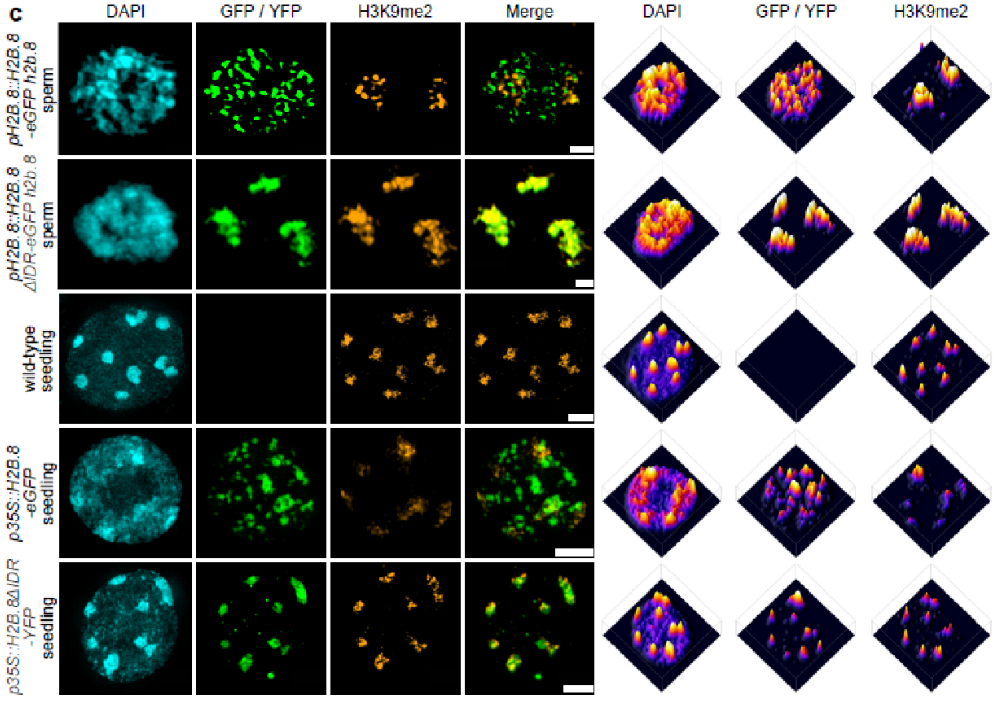
Fig. 2. H2B.8对染色质浓缩是充分必要的。
与经典的H2B
(canonical H2B, cH2B)
相比,H2B.8在其N端tail区域多出一段约90个氨基酸的固有无序区
(Intrinsically disordered region,IDR)
,其近最末端一个关键的泛素化位点发生了变异,由cH2B的赖氨酸变为天冬酰胺。通过与cH2B的结构域互换和点突变结合转基因表型分析,作者发现IDR对H2B.8的正常功能是必需的,而泛素化位点的变异不具有显著的功能
(Fig. 2a,c,d)
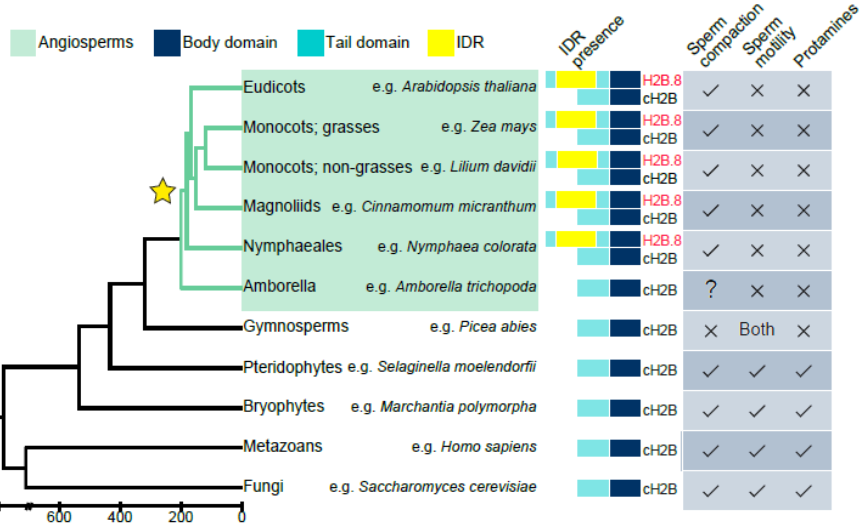
。系统进化分析显示H2B.8是开花植物特有的基因,除早期开花植物无油樟外,其它开花植物亚群均具有H2B.8
(Fig. 3)
。有意思的是,尽管H2B.8-IDR的氨基酸序列在开花植物中并不保守,但它们均是无序的,暗示IDR的无序性而不是氨基酸保守性对其功能是重要的。此外,系统进化分析也暗示H2B.8是开花植物在进化过程中的创新,取代精蛋白实现对精子染色质浓缩的同时,维持其转录活性
(见下文)
。
通过免疫荧光结合3D-SIM,作者观察到H2B.8-GFP能在精核中形成明显的斑点,且不与异染色质共定位,而IDR敲除会使H2B.8富集于异染色质区域
(Fig. 2c)
,说明IDR对于H2B.8的染色质定位起到了非常重要的作用。随后作者利用ChIP-seq进一步确认了细胞学层面的观察结果。通过与已知的基因组特征进行细致的比较分析,作者发现H2B.8倾向分布于富含AT序列的转录沉默的常染色质区,与绝大多数已知的组蛋白修饰均无显著的相关性,代表了一种新型的基因组特征。由于H2B.8不结合在表达的基因组区域, H2B.8突变或过表达均不会改变基因或转座子的转录情况。
那么H2B.8是如何浓缩染色质的呢?由于H2B.8具有IDR,且在细胞内形成核斑点,这属于相分离的典型特征,作者因此推测H2B.8通过相分离介导了精子常染色质浓缩
(Fig. 4)
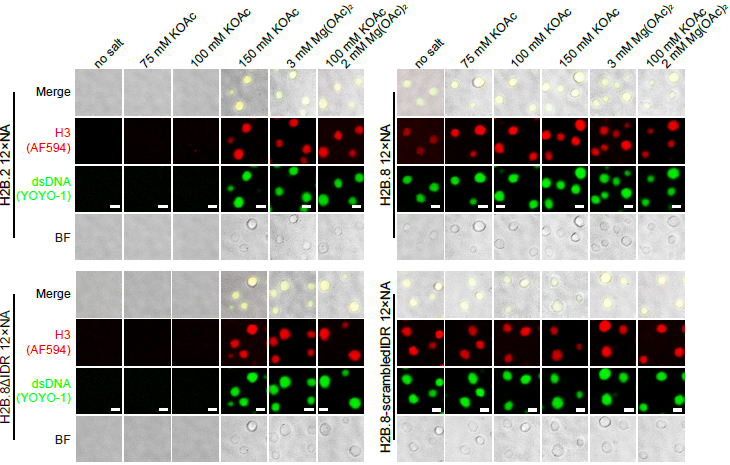
。随后作者利用体外组装核小体实验,证明H2B.8可以介导核小体的体外相分离,且该过程不依赖于阳离子的参与,这与Canonical组蛋白形成的核小体性质迥异。表明了H2B.8具有较强和特异的相分离特性。
作者进一步推测,H2B.8通过相分离机制将染色质“粘”在一起,从而促进浓缩。为了证实这个猜测,作者使用野生型和H2B.8过表达幼苗材料进行高通量染色质构象捕获实验
(Hi-C)
,结果显示H2B.8过表达增强了染色体臂
(常染色质区)
内部的短距离互作以及着丝粒
(异染色质区)
与染色体臂之间的长距离互作,即促进了常染色质浓缩和一定程度的异染色质去浓缩,这与细胞学观察一致
(Fig. 2c)
。ChIP-seq结合Hi-C分析显示增强的染色质区域的互作与H2B.8的分布正相关,证明H2B.8通过相变将其分布的局部染色质聚集而达到浓缩。
最后作者利用一系列遗传学实验证明了H2B.8在不良条件下对精子的竞争力尤为重要,说明了H2B.8介导的精核浓缩对于精细胞竞争力的重要作用。
综上所述,
该文阐释了开花植物精细胞的染色质凝缩机制。通过这个研究,作者发现了一种新型的染色质浓缩机制,这种浓缩仅作用于不表达的常染色质,从而精巧地达到了缩小核的大小并且毫不影响转录的作用。这是真核生物中的首例不影响转录的染色质浓缩机制。
从进化上看,动物和低等植物使用精蛋白将它们精子头部的染色质发生极度的浓缩,以提高精子的游动速度,但是这种极度浓缩抑制了转录,所以动物和低等植物的精子是没有转录活性的。开花植物具有花粉管结构,其精子不具有游动能力,而是在花粉管中被运到胚囊,完成受精。因为不需要游动,相对于动物和低等植物,开花植物的精子压缩的进化压力更小。该研究表明开花植物进化出H2B.8,代替精蛋白,将其精子常染色质非活跃转录区而不是整个基因组进行选择性浓缩,既缩小体积,又不干扰转录,从而促进受精。
Toby Buttress (John Innes Centre)、赫圣博(John Innes Centre,现任职于华南农业大学农学院、岭南现代农业科学与技术广东省实验室)、王亮(清华大学)和周少立(John Innes Centre)博士为本文共同第一作者,英国约翰英纳斯中心(John Innes Centre)冯小琦教授和清华大学李丕龙教授为共同通讯作者。
原文链接:
https://doi.org/10.1038/s41586-022-05386-6
制版人:十一
1. Rathke, C., Baarends, W. M., Awe, S. & Renkawitz-Pohl, R. Chromatin dynamics during spermiogenesis. Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms 1839, 155–168 (2014).
2. Reynolds, W. F. & Wolfe, S. L. Protamines in plant sperm. Exp Cell Res 152, 443-448 (1984).

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。













 个人中心
个人中心
 我是园区
我是园区





