Nat Comm | 甘波谊团队报道Cyst(e)ine调控铁死亡的新机制
收藏
关键词:
Nat新机制
资讯来源:BioArt + 订阅账号
所属行业:化学原料药 + 订阅行业
发布时间:
2021-03-13
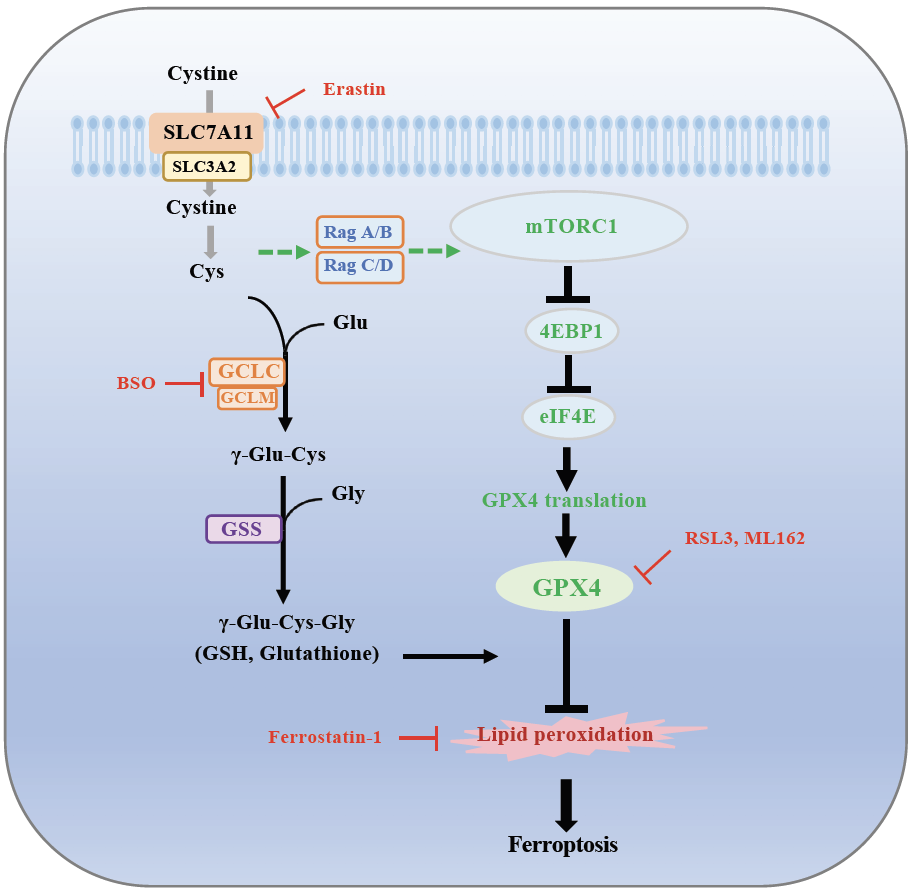
铁死亡是一种由铁依赖的脂质过氧化物导致的调控性细胞死亡。它的调控机制是近些年生命科学领域的研究热点之一。胱氨酸
(Cystine)
转运蛋白SLC7A11介导胱氨酸摄入, 胱氨酸随后在细胞内还原为半胱氨酸
(Cysteine)
参与谷胱甘肽
(GSH)
与蛋白质合成等生物学功能。谷胱甘肽过氧化物酶4
(GPX4)
通过GSH依赖的方式特异性催化脂质过氧化物失去其氧化活性,进而保护细胞免受铁死亡威胁
【1-3】
。一直以来认为,Cyst(e)ine
(cystine 或 cysteine)
缺乏或靶向SLC7A11的药物如erastin等处理可以抑制GSH合成进而影响GPX4功能并诱导铁死亡。但Cyst(e)ine和SLC7A11调控GPX4和铁死亡的详细机制以及是否存在GSH非依赖的调控方式有待深入研究。
Mechanistic target of rapamycin complex 1
(mTORC1)
是具有激酶活性的蛋白复合物体。它是细胞内感知营养物质如氨基酸并控制细胞生长的重要调控中枢。在细胞缺乏氨基酸时,mTORC1可以磷酸化其下游S6K/S6或4EBPs等信号通路进而调控蛋白质翻译合成并维持细胞稳态
【4-5】
。鉴于mTORC1在细胞生长调控中的重要功能以及肿瘤细胞对营养物质过量的需求,靶向mTORC1的抑制剂一直以来是肿瘤治疗领域中的研究重点。深入研究mTORC1调控氨基酸代谢及其介导的生物学功能对于我们充分利用mTORC1抑制剂治疗肿瘤意义重大。
近日,来自美国德克萨斯大学MD安德森癌症中心的甘波谊教授团队在 Nature Communications发表论文:
mTORC1 couples cyst(e)ine availability with GPX4 protein synthesis and ferroptosis regulation
,
发现cyst(e)ine通过不依赖于GSH调控铁死亡的新机制。Cyst(e)ine缺乏可以通过抑制Rag-mTORC1-4EBPs信号通路及其介导的GPX4蛋白翻译表达调控铁死亡。
值得一提的是, 甘波谊教授团队近年在国际知名杂志,如 Nature Cell Biology, Cell Research,已经发表多篇论文阐述铁死亡和胱氨酸代谢与肿瘤发生及治疗的关系(
【6-10】
。
SLC7A11可以通过cyst(e)ine介导的GSH合成调控GPX4活性并影响铁死亡,但有包括作者在内的多项研究发现抑制GSH合成并不能显著诱导铁死亡。甘教授实验室的张义磊博士等人为了深入研究导致这种差异的背后原因,使用质谱技术分析在cystine饥饿条件下肿瘤细胞内蛋白组的变化。结果发现,GPX4蛋白在cystine饥饿条件显著性下调。进一步使用抑制cystine摄入靶向SLC7A11的试剂erastin或直接敲除SLC7A11基因表达均验证了这一现象。更为重要的是,cystine缺乏引起的GPX4下降不是因为mRNA水平降低或蛋白酶体及自噬介导蛋白降解所致。通过鉴定核糖体中GPX4的mRNA水平发现,cystine缺乏可以显著抑制GPX4蛋白水平的翻译。
研究人员进一步发现mTORC1在cystine缺乏时受到明显抑制,而使用mTORC1的抑制剂Torin1但不是Rapamycin时可以显著抑制GPX4的蛋白水平。由于Torin1, 而不是Rapamycin, 可以显著抑制4EBP磷酸化, 这一发现提示mTORC1通过下游4EBP介导的蛋白翻译调控GPX4。进一步通过RagA/B、4EBP1/2等基因的敲除细胞系和4EBP1非磷酸化突变体证明,cystine通过Rag-mTORC1-4EBPs通路调控GPX4蛋白表达和铁死亡。使用mTORC1的抑制剂如Torin1或AZD8055可以通过抑制GPX4的蛋白水平从而显著提高肿瘤细胞对铁死亡的敏感性。联合使用mTORC1的抑制剂和铁死亡诱导剂能够更加显著地抑制PDX模型中肿瘤的生长。
该研究阐明氨基酸通过mTORC1调控铁死亡的新途径,并为靶向mTORC1的肿瘤治疗提供了新的理论指导。
该论文的第一作者张义磊博士从事肿瘤生物学、表观、代谢以及铁死亡等方向的研究,以第一作者、共同第一作者或通讯作者在Nature Cell Biology (2020,2018)、Nature Communications (2021)、Cancer Research (2020)、Cell Research (2020)、Journal of Biological Chemistry (2017)、Oncogene (2015)等杂志发表论文多篇。张博士已于近期加入西安交通大学基础医学院并开始组建独立的研究团队。西安交通大学基础医学院张义磊博士研究团队欢迎博士后、研究生、本科生等科研人员加入,共同探索生命科学的奥秘,为生物医学的发展助力!
https://jinshuju.net/f/ZqXwZt
或
扫描二维码
投递简历
https://www.nature.com/articles/s41467-021-21841-w
1. Stockwell BR, et al. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell 171, 273-285 (2017).
2. Yang WS, et al. Regulation of ferroptotic cancer cell death by GPX4. Cell 156, 317-331
(2014).
3. Ingold I, et al. Selenium Utilization by GPX4 Is Required to Prevent Hydroperoxide-
Induced Ferroptosis. Cell 172, 409-422 e421 (2018).
4. Saxton RA, Sabatini DM. mTOR Signaling in Growth, Metabolism, and Disease. Cell.
169, 361-371 (2017).
5. Kim J, Guan KL. mTOR as a central hub of nutrient signalling and cell growth.
Nature cell biology
21, 63-71 (2019).
6. Zhang Y, et al. BAP1 links metabolic regulation of ferroptosis to tumour suppression. Nature cell biology 20, 1181-1192 (2018).
7. Lee H, et al. Energy-stress-mediated AMPK activation inhibits ferroptosis. Nature cell biology 22, 225-234 (2020).
8. Lei G, et al. The role of ferroptosis in ionizing radiation-induced cell death and tumor suppression. Cell Res 30, 146-162 (2020).
9. Liu X, et al. Cystine transporter regulation of pentose phosphate pathway dependency and disulfide stress exposes a targetable metabolic vulnerability in cancer. Nature cell biology 22, 476-486 (2020).
10. Koppula P, Zhuang L, Gan B. Cystine transporter SLC7A11/xCT in cancer: ferroptosis, nutrient dependency, and cancer therapy. Protein Cell https://doi.org/10.1007/s13238-020-00789-5 (2020).
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 药选址
药选址



