国内创新药大丰收!石药、天晴 1 类新药申报上市,信达 PD-1 两大一线适应症获批… | Insight 创新药周报
收藏
关键词:
PD-1上市新药石药适应症获批创新药周报信达药
资讯来源:Insight数据库 + 订阅账号
发布时间:
2022-06-26
据
Insight 数据库
统计,本周(6 月 20 日 - 6 月 25 日)从全球维度来看共有
47 款
新药(含类似药及改良新)研发进度推进到了新的阶段,包括 5 款新申报上市,3 款新获批上市;早期新药项目中 13 款首次启动临床,17 款首次申报临床。
而国内企业创新药动态爆发增长,逐渐走出疫情所带来的负面影响,本周有 46 款药物进入新的研发阶段。Insight 本周将分别摘取国内外重要新药项目进展作介绍(附列表)。文章篇幅较长,可选择性阅读。
本周国内共 55 款新药进展到了新的阶段,其中国内企业参与的有 46 款。具体阶段而言,包括 3 款获批上市、4 款申报上市、2 款首次启动 III 期临床、15 款首次启动临床、21 款首次申报临床。
据 Insight 数据库 显示,
该药首次
临床申报在 2015 年 10 月,迄今已经启动了 6 项临床试验,其中包括 3 项 II 期临床,分别针对 ROS1 阳性非小细胞肺癌、ALK 阳性复发/难治性间变性大细胞淋巴瘤(ALCL)。从临床进展推测,申报上市适应症大概率为:ROS1 阳性非小细胞肺癌。
正大天晴在 2022 ELCC 上公布了针对 ROS1 融合阳性晚期 NSCLC 患者的 2 期临床试验(CTR20191078)数据。该研究由陆舜教授和潘宏铭教授担任主要 PI,结果显示,独立评审委员会(IRC)评估的 ORR 为 78.4%(95%CI, 69.6-85.6),mPFS 为 15.6 个月(95%CI, 10.2-27.0),mDoR 为 20.3 个月(95%CI, 11.0-26.1)。详见下图:
* Insight 数据库即将在 6 月 30 日上线「临床试验结果」模块,提供丰富的筛选检索项、表格+可视化两种数据展示形式,并与数据库全球新药模块打通,轻松掌握新药全生命周期数据,敬请期待~
值得一提的是,正大天晴在 5 月末刚刚申报了另一款 1 类新药 TQ-B3139,针对 ALK 阳性 NSCLC。Insight 数据库 显示,该企业目前有 CDK4/6 抑制剂 TQB3616、三代 EGFR 抑制剂 FHND9041、PD-L1 单抗 TQB2450 这 3 款新药处于 III 期临床,上市申报在即。
6 月 22 日,CDE 官网显示,石药集团子公司津曼特的 1 类新药「纳乐舒单抗注射液」申报上市获受理(受理号>>CXSS2200061),根据企业公告,该产品即为 RANKL 单抗 JMT103。
据Insight 数据库
显示
,JMT103 最早于 2016 年 8 月申报临床,除骨巨细胞瘤外,还有多项适应症处于临床开发当中,包括肿瘤骨转移、骨质疏松症、骨恶性肿瘤高钙血症等。
JM
T103 是新一代创新型全人源抗 RANKL(IgG4)单克隆抗体,可通过抑制多核破骨细胞的生成从而阻断多核破骨细胞介导的骨吸收。
今年 3 月,石药宣布 JMT103 在治疗不可切除或手术困难的骨巨细胞瘤的关键临床试验中达到预设终点。
JMT103 的 2 期单臂关键注册临床研究(JMT103CN03 )共纳入了 139 名骨巨细胞瘤受试者,结果显示,
JMT103 肿瘤反应率高达 93.5%,起效时间较快,且治疗后提高了可以手术切除的骨巨细胞瘤患者比例;此外,骨巨细胞瘤患者疼痛程度得到缓解,生活质量得到改善。
目前国内 RANKL 单抗多为地舒单抗及其生物类似药,创新药之中,纳乐舒单抗为国产首款申报上市。
本周国内 3 款改良新药获批上市,包括两款来自于齐鲁制药的口溶膜制剂;此外,信达生物 PD-1 单抗信迪利单抗的两大一线适应症也在周一和周五分别获批上市。
本周五,齐鲁制药的两款改良型新药美金刚口溶膜、阿立哌唑口溶膜同时获批上市,均为国内首款。
美金刚是一款阿尔茨海默病治疗药物,属于非竞争性 NMDA 受体拮抗剂,通过抑制 NMDA 受体的过度激活以减少兴奋性毒性、保护神经元,同时不影响认知所需要的 NMDA 受体的生理性活化。目前据 Insight 数据库 显示,除口溶膜外国内美金刚在研剂型包括片剂(53)、胶囊剂(10)、口崩片(4)、缓释/控释胶囊(18)、颗粒剂(1)、口服液体制剂(12)。其中口崩片、颗粒剂尚无获批。
阿立哌唑是一款抗精神病用药,全球范围内已获批的适应症包括精神分裂症、急性躁狂、双相障碍及相关激越症状等。据 Insight 数据库 显示,除口溶膜之外,国内阿立哌唑在研剂型包括片剂(27)、胶囊剂(5)、口崩片(13)、口服液体制剂(10)、注射剂(2)、注射用微球(1)。其中注射剂尚无企业获批上市。
口溶膜是一种新型口服制剂,是药物与适宜的成膜材料加工制成的膜状制剂,放入口中即粘在给药部位,不易吐出,快速分散,可减少患者不配合服药的现象;对于全身作用的药物来说,活性物质可以经口腔黏膜直接吸收,避免首过效应。
在国内仿制药竞争激烈叠加集采的情况下,探索更适合患者的改良型新药或许是个不错的选择。齐鲁是国内口溶膜领先企业,且更多专注于神经系统药物,本次获批的两款药物同属于这一领域。这部分患者尤其需要依从性更好的给药方式。
据
Insight 数据库
显示
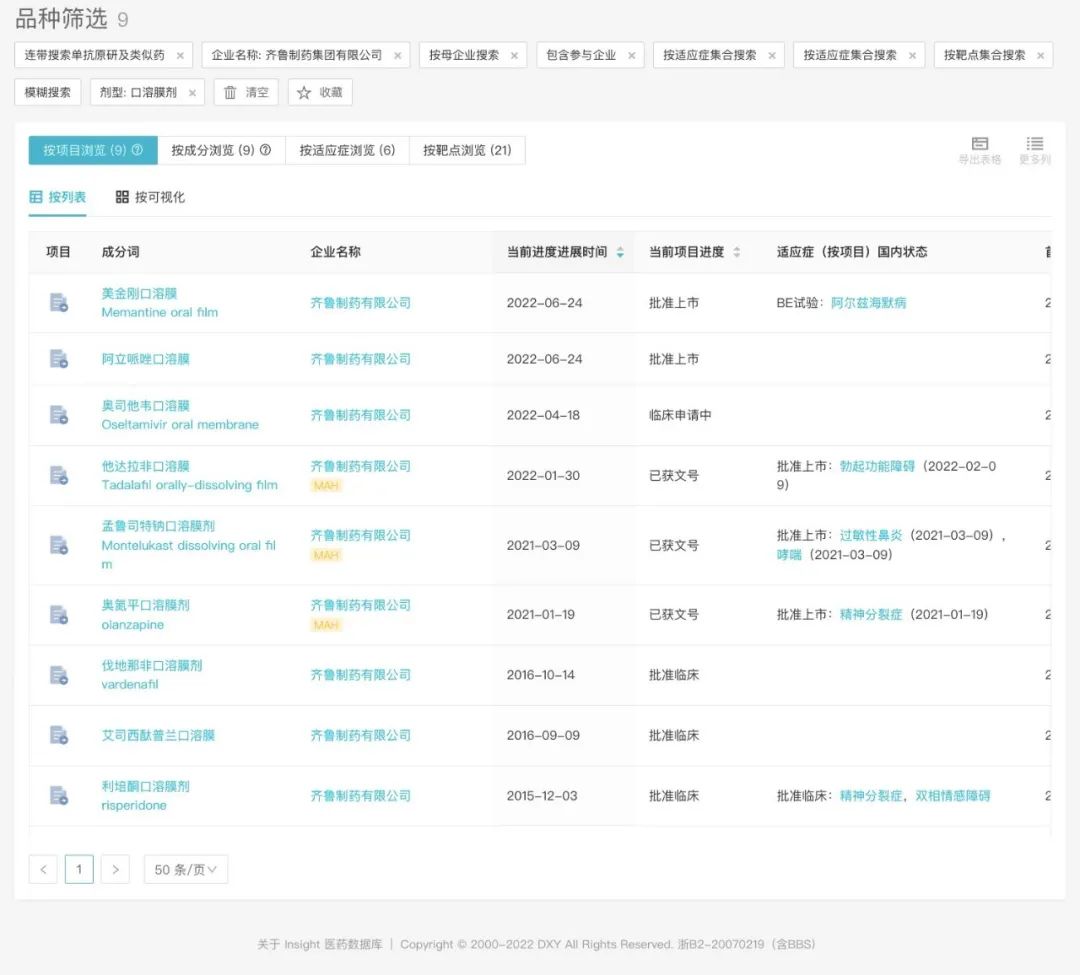
,齐鲁已经开发了多款国内首款口溶膜剂,以满足患者尚未解决的治疗需求。目前,
齐鲁已有 9 个口溶膜项目开发
,其中 5 款已经获批上市,详见下图:
本周,信迪利单抗获批两项新适应症:(1)联合化疗一线治疗不可切除的局部晚期、复发性或转移性食管鳞癌;(2)联合化疗一线治疗不可切除的局部晚期、复发性或转移性胃或胃食管交界处腺癌。这是信迪利单抗获批的第 5 和第 6 项新适应症。
这两项适应症均在 6 月 30 日获得批准,意味着将在今年的医保谈判中亮相,有望在明年
初就正式进入医保支付范围。
信迪利单抗一线食管鳞癌适应症和一线胃癌适应症分别基于 III 期临床试验 ORIENT-15 研究和 ORIENT-16 研究的数据。据 Insight 数据库 显示,这两项临床数据均在 2021 ESMO 大会上公布,详细数据如下:
ORIENT-15 临床试验结果(Insight)
ORIENT-16 临床试验结果(Insight)
* Insight 数据库即将在 6 月底上线「临床试验结果」模块,提供丰富的筛选检索项、表格+可视化两种数据展示形式,并与数据库全球新药模块打通,轻松掌握新药全生命周期数据,敬请期待~
此外值得一提的是,信迪利单抗是目前唯一获批一线治疗胃癌的国产 PD-1 单抗,有望使国内患者迎来首款医保支付范围内的胃癌免疫疗法。不过同样在本周,百济神州的 PD-1 单抗替雷利珠单抗也申报了一线胃癌适应症。
本周国内共 15 款新药首次启动临床,包括 11 款创新药、2 款改良新、2 款生物类似药。企业方面,本周 MVP 为石药集团,新药、改良新、生物类似药各有 1 款首次公示启动临床。篇幅有限,此处不再赘述,更多新药信息可点击>> Insight 数据库全球新药模块 直达查询。
本周境外共有
8
款新药(含
改良新)研发进度推进到新阶段。除此之外,新适应症的申报获批也颇受关注,包括第一三共/阿斯利康 Enhertu、百时美施贵宝 CAR-T 疗法、艾伯维 CGRP 拮抗剂等。
企业名称:
Menarini Group/Radius Health
近期,Menarini Group 与 Radius Health 联合宣布已向美国 FDA 递交口服选择性雌激素受体降解剂(SERD)elacestrant 的新药上市申请(NDA),用于治疗 ER+/HER2- 晚期或转移性乳腺癌患者。这项申请基于 III 期临床试验 EMERALD 研究的积极数据。两家公司还表示,计划于 2022 年下半年向欧盟 EMA 递交上市许可申请(MAA)。
Elacestrant 即艾拉司群,据 Insight 数据库 显示,艾拉司群最早由卫材研发,而后与 Menarini 和 Radius 达成合作。
艾拉司群是全球首个在关键注册临床中获得获得积极顶线结果的口服 SERD 类药物。EMERALD 研究是一项随机、开放标签、活性对照的 III 期临床试验,评估 elacestrant 作为二线或三线单药疗法治疗 ER+/HER2- 晚期或转移性乳腺癌的疗效和安全性。该项研究共纳入了 477 例患者,试验的主要终点为总体病患与带有 ESR1 基因突变病患的无进展生存期(PFS),而次要终点则是总生存期(OS)、客观缓解率(ORR)与缓解持续时间(DOR)。其临床结果详见下图:
本周,百时美施贵宝的 CD19 靶向 CAR-T 疗法 Breyanzi 连续达到两项里程碑,新适应症在欧洲申报上市获受理,并在美国获批上市。
6 月 20 日,BMS 宣布欧洲 EMA 已经受理 CD19 靶向 CAR-T 疗法 Breyanzi(研发代号:JCAR017)二线治疗,用于一线治疗失败后复发或难治性大 B 细胞淋巴瘤(LBCL)成人患者。6 月 25 日,这项适应症获 FDA 批准在美国上市。
Breyanzi 是首个在二线治疗中取得成功的 CAR-T 疗法。在 2021 年 6 月 10 日,BMS 宣布随机、全球多中心 III 期临床试验 TRANSFORM 研究(NCT03575351)达到了主要终点和关键次要终点,相较于标准疗法具有统计学意义的改善,拉开了细胞疗法向更前线治疗进军的序幕。在欧美的申报正是基于该项研究。
在 2021 年末的 ASH 大会上,BMS 以口头汇报的形式公布了 TRANSFORM 研究的结果。该项研究共纳入 184 名患者,1:1 随机接受 Breyanzi 或标准疗法。数据详见下图:
TRANSFORM 研究在 2021 ASH 上发布的最新数据(Insight)
目前据 Insight 数据库
显示,全球已有 7 款 CAR-T 疗法获批上市。其中,BMS、吉利德、诺华这三家已经向二线疗法发起冲击。
尽管 Breyanzi 率先取得临床成功,但吉利德在 CAR-T 疗法的前线拓展上领先一步。2021 年 6 月 28 日,也就是 BMS 公布临床成功当月,吉利德也官宣了 Yescarta 二线 3 期临床 ZUMA-7 研究的积极结果,并在同年 10 月率先申报上市,今年 4 月初获批。
相较于 TRANSFORM 研究,ZUMA-7 研究是首个、同时规模最大的 CAR-T 细胞疗法二线治疗 R/R LBCL 的 3 期随机研究,在全球 77 个中心招募了 359 名患者。另外,作为同靶点同适应症的 CAR-T 疗法,Yescarta 和 Breyanzi 也是直接竞争关系。
另一家开发二线适应症的企业是诺华,然而遗憾遭遇失败。
2021 年 8 月,诺华宣布 Kymriah 折戟二线侵袭性 B 细胞非霍奇金淋巴瘤
(NHL)
,III 期临床 BELINDA 研究最终未能达到无事件生存
(EFS,Event Free Survival)
的主要终点。
药品名称:
Enhert
u(Trastuzumab deruxtecan,DS-8201)
6 月 22 日,第一三共宣布欧盟 EMA 已受理 HER2 ADC 新药 trastuzumab deruxtecan(DS-8201,T-DXd,Enhertu®)的新适应症上市申请(Type II Variation application),针对既往接受过至少一次系统治疗后进展或辅助治疗后六个月内复发的 HER2 低表达(IHC 1+ 或 IHC 2+/ISH-)乳腺癌患者。
Enhertu 是第一三共与阿斯利康联合开发的 Best-in-class HER2 ADC。在 2022 ASCO 全体大会上,第一三共公布了针对 HER2 低表达乳腺癌的 III 期临床试验 DESTINY-Breast04 研究数据并同步发表于 NEJM,引起轰动。本周这一适应症终于申报上市。
据 Insight 数据库 显示,第一三共已经针对 Enhertu 构建了治疗版图,覆盖到乳腺癌领域 HER2 阳性群体及 HER2 低表达群体的各线治疗,逐渐取代既往标准疗法,实现 HER2 靶向治疗的制霸。在乳腺癌之后,第一三共还将探索 Enhertu 在胃癌(GC)、非小细胞肺癌(NSCLC)、结直肠癌(CRC)中的疗效。
Enhertu 适应症开发甘特图(*仅统计 II 期临床及以上)
免责声明:本文仅作消息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
投稿:微信 insightxb;邮箱 insight@dxy.cn






























 药选址
药选址





























