▎药明康德内容团队编辑
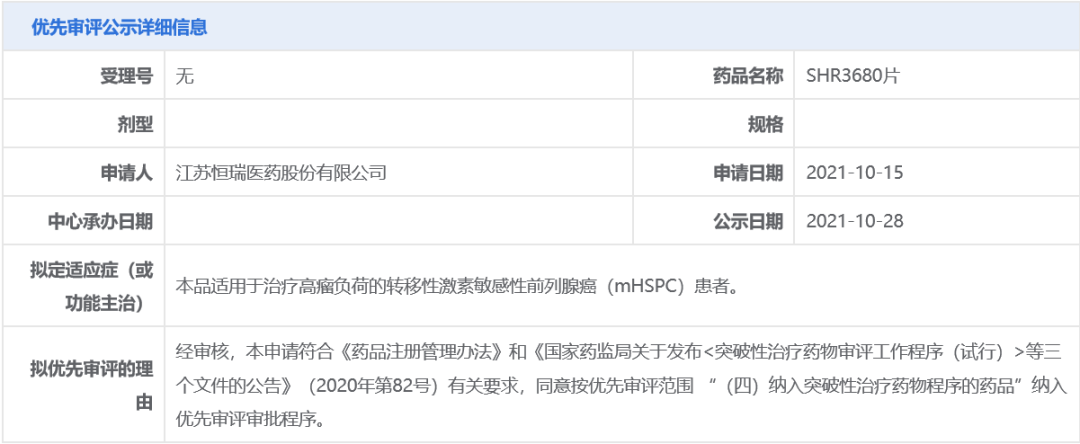
10月28日,恒瑞医药宣布,其新一代AR拮抗剂SHR3680的上市申请已获得中国国家药监局药品审评中心(CDE)受理,并以“纳入突破性治疗药物程序的药品”拟纳入优先审评,拟开发适应症为:治疗高瘤负荷的转移性激素敏感性前列腺癌(mHSPC)患者。此前,
SHR3680针对该适应症已在一项3期临床中达主要终点,并已被CDE纳入突破性治疗品种
。
SHR3680是恒瑞医药研发的一款新型雄激素受体(AR)拮抗剂,属于1类新药。根据恒瑞医药早前发布的新闻稿,相较于第一代AR抑制剂,SHR3680具有更强的AR抑制作用,且无激动作用。
7月15日,恒瑞医药宣布,SHR3680在一项治疗前列腺癌的3期临床试验中达到主要研究终点。这是一项多中心、随机、对照3期临床研究(研究编号:SHR-3680-III-HSPC),旨在评估与标准治疗联合ADT相比,SHR3680联合雄激素剥夺疗法(ADT)治疗高瘤负荷mHSPC患者的效果。
由独立数据监察委员会(IDMC)判定的数据显示,主要研究终点
无影像学进展生存期的期中分析结果达到方案预设的优效标准,
SHR3680可显著降低高瘤负荷的mHSPC患者的疾病进展或死亡风险。
前列腺癌细胞的生长具有特征性的雄激素依赖性,故初诊的转移性前列腺癌患者对雄激素剥夺疗法治疗敏感。近期研究表明,新型雄激素受体拮抗剂联合ADT治疗mHSPC,能够有效降低疾病进展或死亡风险,延长患者的总生存期(OS)。
公开资料显示,除了获得无影像学进展生存期(rPFS)期中分析阳性结果的研究外,SHR3680另有单药和联合多西他赛等多个针对转移性去势抵抗性前列腺癌的2期和3期临床研究正在进行中。
此次SHR3680申报上市并拟纳入优先审评,意味着该产品有望在中国获得加速获批。期待该药在后续药品注册中进展顺利,早日为患者带来新的治疗选择。
参考资料:
[1]中国国家药监局药品审评中心. Retrieved Oct 28,2021, from https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026d
[2]新突破!恒瑞1类新药SHR3680治疗前列腺癌III期临床达到主要研究终点 . Retrieved July 15,2021, from https://mp.weixin.qq.com/s/HPl5s_DKhEo_3iCemhpCMg
本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。







 个人中心
个人中心
 我是园区
我是园区




