蛋白降解剂一般由3部分组成:靶蛋白binder、linker以及E3泛素连接酶binder。PROTAC分子的一端与靶蛋白结合,另一端与E3泛素连接酶结合。E3泛素连接酶是目标蛋白泛素化,蛋白酶体则识别和降解被标记的靶蛋白。
近日,Arvinas在美国癌症研究协会(AACR)上首次披露了ARV-110及雌激素受体降解剂ARV-471的结构,这
为人们设计合成口服有效的PROTAC提供了一个范例。
PROTAC优势1:
降解活性蛋白和支架蛋白质。
IRAK4是一种既能激活IL-1家族受体又能激活Toll样受体(TLR)炎症信号的激酶。由于 IRAK4蛋白也发挥支架功能, IRAK4抑制剂研发一直停滞不前,降解剂的出现使其成为可能的潜在治疗靶标。KT-474是目前临床上唯一的非肿瘤降解剂,研发适应症包括特应性皮炎和化脓性汗腺炎。Kymera的KT-413是一种具有保守IMiD活性的IRAK4降解剂,将于今年晚些时候进行癌症临床试验。
BRD9能识别组蛋白和其他蛋白质上的乙酰化赖氨酸,在表观遗传中具有重要功能动,而新的数据表明BRD9的
支架功能
可能
驱动了其在
罕见肉瘤中的作用
。
虽然小分子能以高选择性结合和抑制BRD9,但细胞活性不尽理想。而
BRD9的降解显著抑制了小鼠肿瘤模型的进展。
PROTAC优势2:
新的细胞选择性。
人类蛋白质组中估计有600个E3连接酶,每个酶具有不同的细胞表达谱。
降解剂细胞类型选择性最终取决于细胞中不同的E3连接酶表达谱。
BCL-XL是一种抗凋亡蛋白,
靶向BCL-XL会杀死血小板细胞,从而导致剂量限制性血小板减少毒性。研究发现
,VHL连接酶在血小板中表达水平很低。
DT2216作为BCL-XL降解剂在保留
血小板活性的同时,具有很好的抗肿瘤效果,目前针对
T细胞淋巴瘤和小细胞肺癌的临床实验正在进行之中。
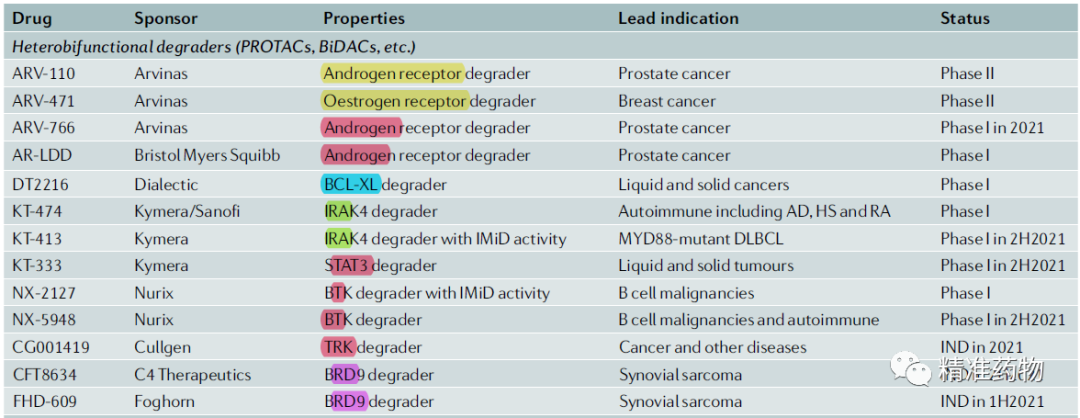
目前,至少13个PROTAC药物已经进入临床阶段,靶点包括
AR
,ER,BCL-XL,IRAK4,STAT3, BTK, TRK,BRD9
等:
除PROTAC外,分子胶(glue degrader)也可成功诱导靶蛋白的降解。分子胶降解剂是一类可诱导E3泛素连接酶底物受体与靶蛋白之间相互作用,从而导致靶蛋白降解的小分子。沙利度胺类抗癌药物是分子胶的一个典型代表,这类药物可重定向E3泛素连接酶CRBN,从而使转录因子IKZF1和IKZF3多聚泛素化并被蛋白酶体降解。
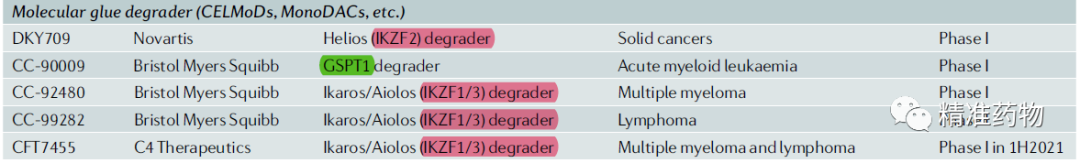
目前处于临床研究阶段的分子有5个,靶点包括
IKZF2,IKZF1/3,GSPT1
等:
双功能降解剂可以预先选择一个靶点,然后寻找相关的配体来捕获它。
相比之下,分子胶则受到迄今为止已确定的一小部分E3分子活性谱的限制。
到目前为止,只有大约“24到30”个IMiD新底物被报道,但“最终的统计数字将远远高于这个数字。”
来源:Nature Reviews Drug Discovery
20
, 247-250 (2021)
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。






 药选址
药选址



