
“母体胚胎转换(Maternal-to-zygotic transition,MZT)”是所有动物生命历程的第一个重要的发育事件。通过母源提供的mRNA和蛋白质及时降解以及胚胎基因组转录激活,将胚胎的发育从母源控制转变为胚胎控制。浙江大学范衡宇课题组之前报道哺乳动物中母源mRNA的清除是由两个紧密相连的过程调节的:卵母细胞减数分裂成熟过程中,母源性因子(包括去腺苷酸化酶复合体CCR4-NOT的关键催化亚基CNOT6L、CNOT7,“母体胚胎转换”的准许因子BTG4及其适配因子PABPN1L)调控的mRNA降解,称为母源性降解(Maternal decay,M-decay);受精以后,合子基因组表达胚胎因子,促进母源mRNA进一步降解,称为合子性降解(Zygotic decay,Z-decay)。其中,mRNA末端尿嘧啶化修饰酶TUT4和TUT7介导的3ʹ端尿苷化修饰促进Z-decay。然而,具体的Z-decay调节通路和其他关键胚胎因子还尚不清楚。
2021 年12 月14日,浙江大学范衡宇课题组在Nucleic Acids Research上发表论文:Nuclear Poly(A) Binding Protein 1 (PABPN1) Mediates Zygotic Genome Activation-dependent Maternal mRNA Clearance During Mouse Early Embryonic Development。鉴定PABPN1为一个合子表达的母源mRNA去稳定因子,并揭示了其在哺乳动物早期胚胎发育过程中的细胞质新功能。

多聚腺苷酸 (Poly(A)) 尾巴在基因表达的转录后调控中起着重要作用,并始终被它的结合蛋白PABPs(poly(A)-binding proteins)包裹。课题组前期研究发现,PABPN1的同源蛋白PABPN1L在卵母细胞中特异性表达,招募BTG4-CCR4-NOT去腺苷酸化复合体到母源mRNA的poly(A)尾巴上,促进M-decay。Pabpn1l敲除雌鼠可以排出形态学正常的卵母细胞,但是受精以后胚胎阻滞在1到2细胞期,无法生育。
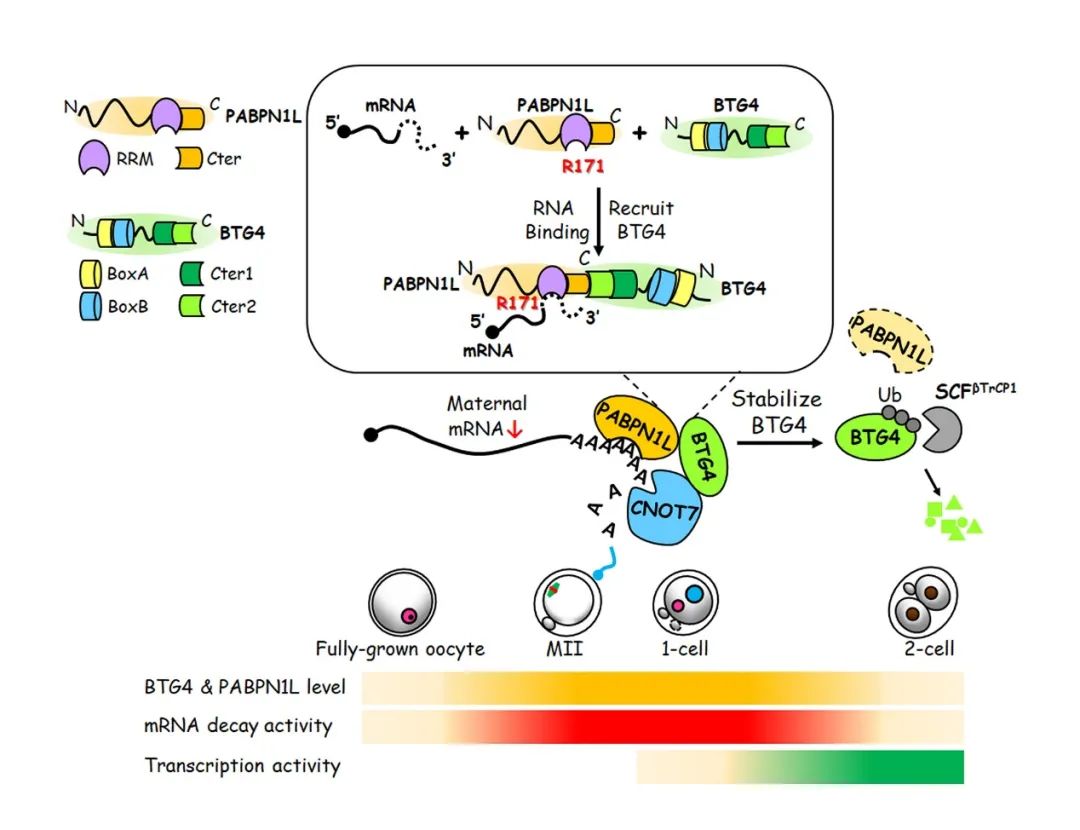
图1:PABPN1L在“母体胚胎转换”过程中调控母源mRNA降解以及稳定BTG4的功能示意图,色带代表蛋白水平与活性,蛋白的功能域在左上角标出。(范衡宇实验室,EMBO Reports,2020)
与母源表达的PABPN1L不同,该课题组观察到它的同家族基因PABPN1,在受精以后伴随着胚胎基因组激活出现显著表达,并在早期胚胎发育过程中呈现出独特的细胞质-细胞核分布谱。
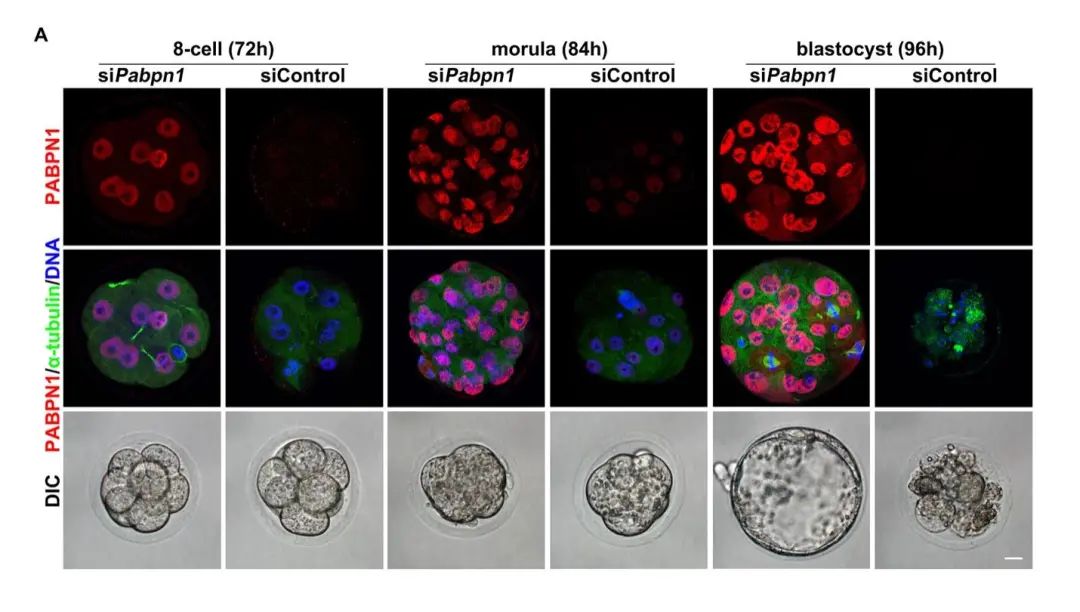
图2:PABPN1缺失导致小鼠早期胚胎在桑椹胚时期死亡。
研究者试图构建Pabpn1敲除小鼠,却发现其敲除胚胎在桑椹胚时期致死。结合转录组学分析得出Z-decay母源转录本在2细胞期大量累积。进一步的生化机理研究表明细胞质中的PABPN1通过招募特异性降解尿苷化修饰的3ʹ-5ʹ核酸外切酶DIS3L2,到TUT4/7调节的3ʹ端尿苷化修饰的母源mRNA上,促进Z-decay的顺利进行。与之前观察到的TUT4/7缺失表型相似,PABPN1调节的Z-decay途径受阻,会造成早期胚胎囊胚发育缺陷。
本研究首次报道PABPN1敲除小鼠的生理表型,揭示了PABPN1全新的细胞质功能和在早期胚胎发育中的生理意义,完善了哺乳动物Z-decay调节通路,并强调了PABPN1作为必要的胚胎因子潜在影响人类生殖的重要性。
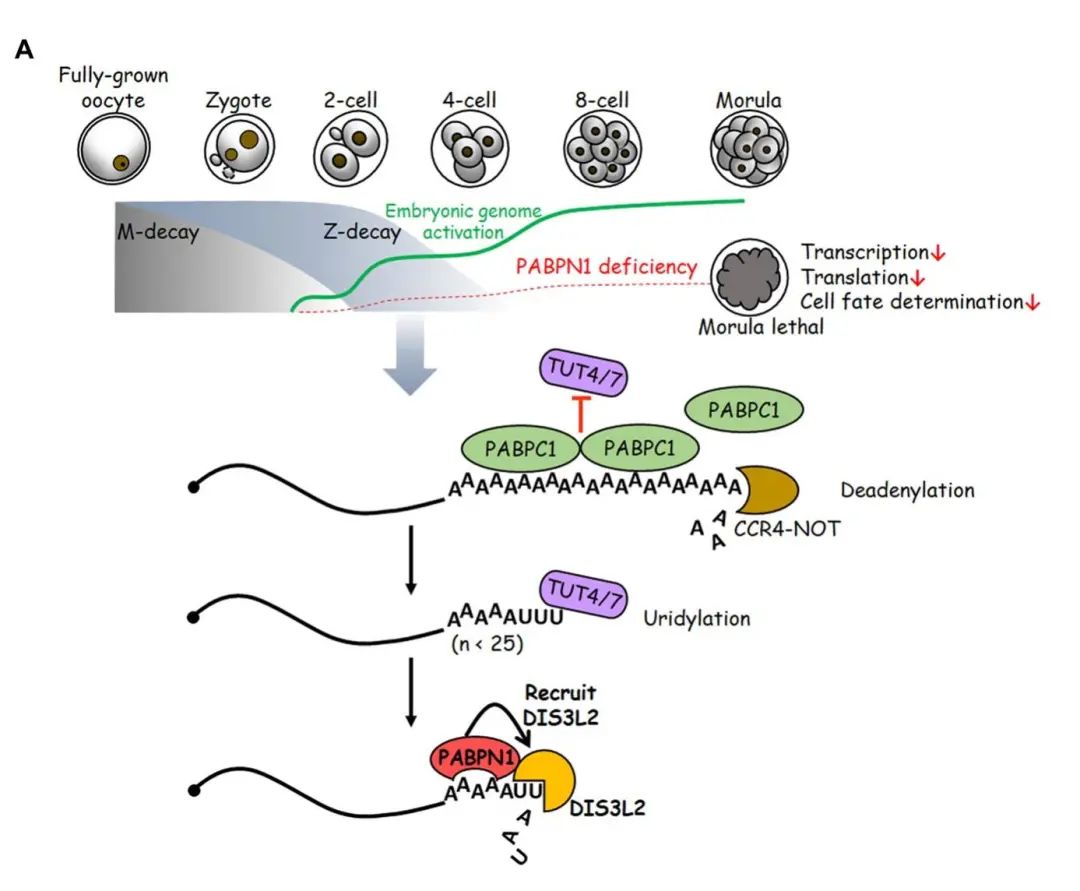
图3:PABPN1作为胚胎因子调控Z-decay的功能示意图。Z-decay转录本首先由CCR4-NOT进行去腺苷酸化,之后TUT4/7在其3ʹ端进行寡聚尿苷化修饰,合子基因组激活表达的PABPN1招募DIS3L2到尿苷化修饰的母源mRNA上,促进Z-decay。该功能对于维持胚胎基因组的持续激活以及胚胎发育潜能至关重要。
浙江大学生命科学研究院范衡宇课题组赵龙雯博士为该论文的第一作者,沈立课题组博士研究生朱业张和范衡宇课题组博士研究生吴韵雯,皮帅玻在工作中也有重要贡献,通讯作者为范衡宇教授。
原文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab1213/6460794
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




