12 月份
获批临床报告
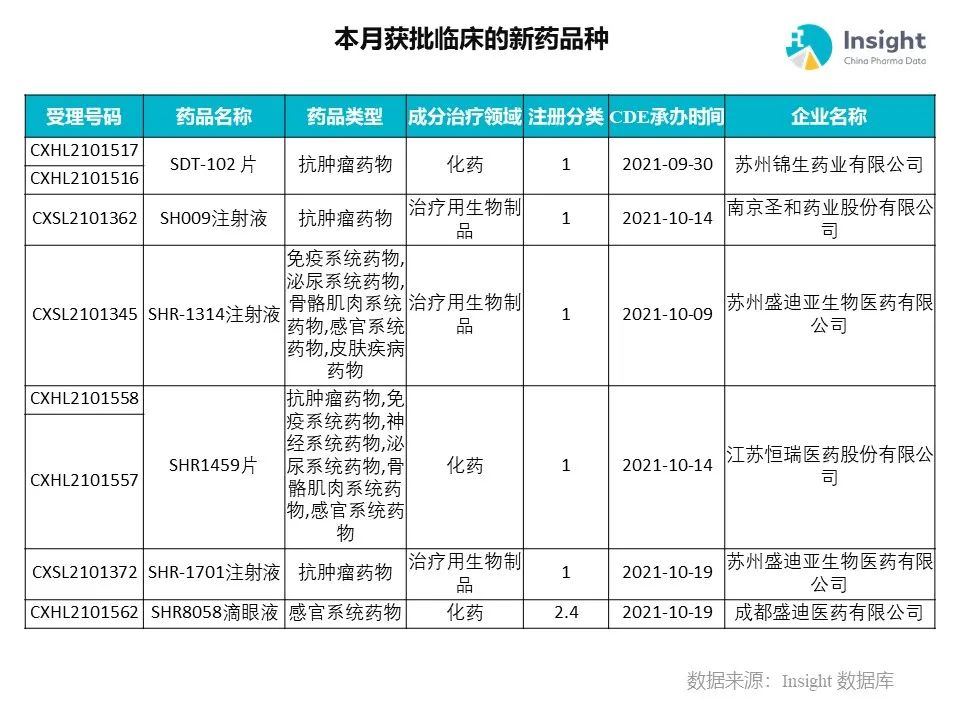
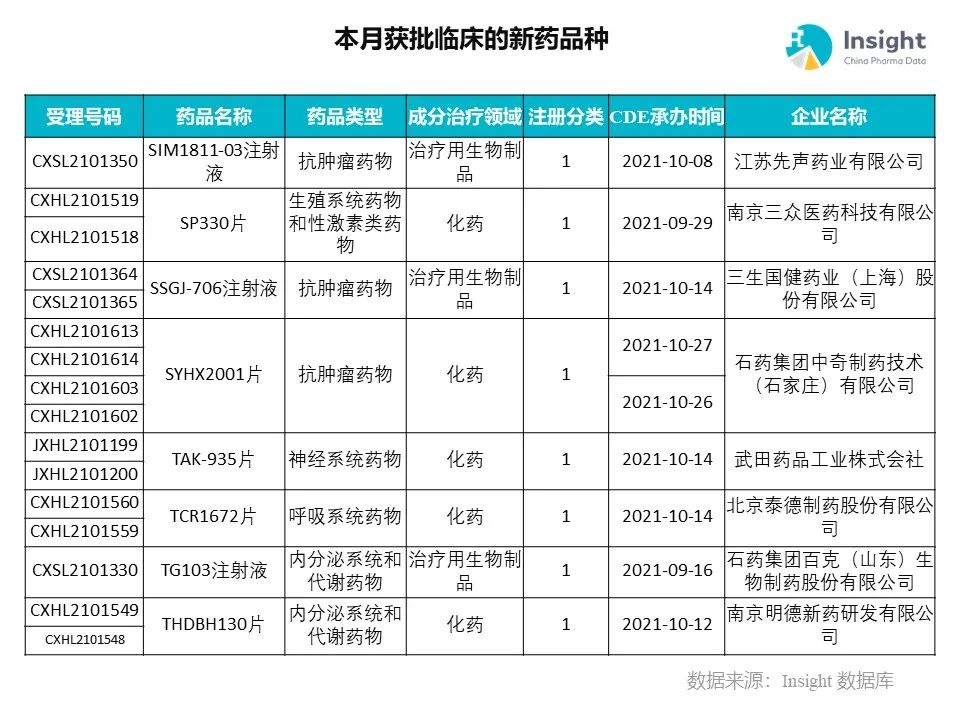
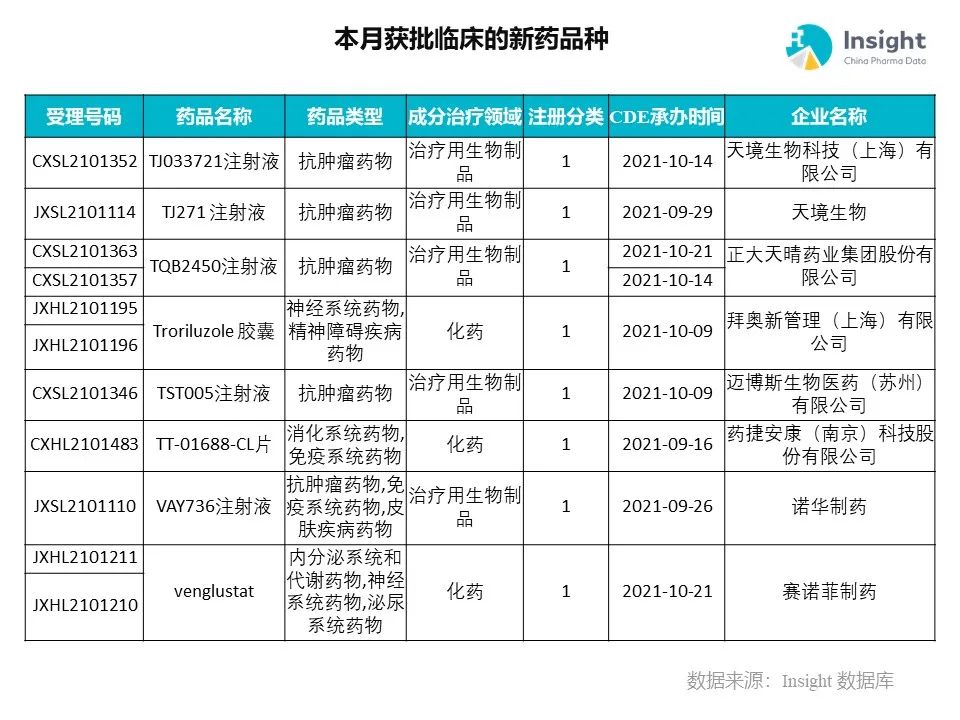
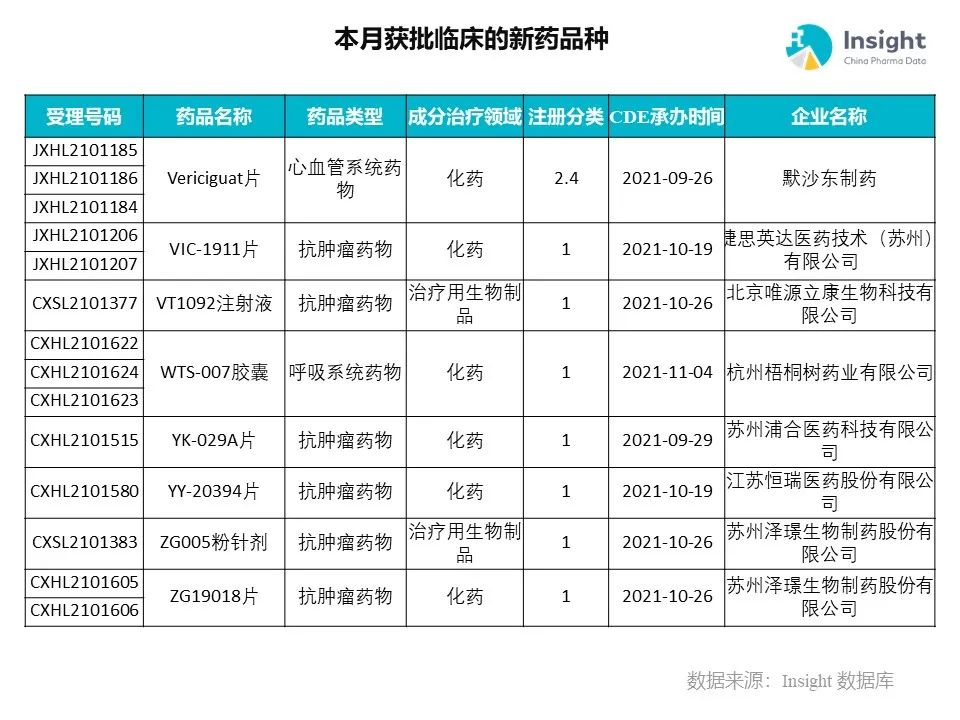
◆ 12 月获批临床的新药共有 200 个受理号,涉及 123 个品种(附名单)
本报告数据来源:Insight 数据库、CDE 药物临床试验登记与信息公示

本月获批临床新药品种
Insight 数据库(https://db.dxy.cn)申报进度库显示,2021 年 12 月获批临床的新药共有 200 个受理号,涉及 123 个品种,下图为具体名单:
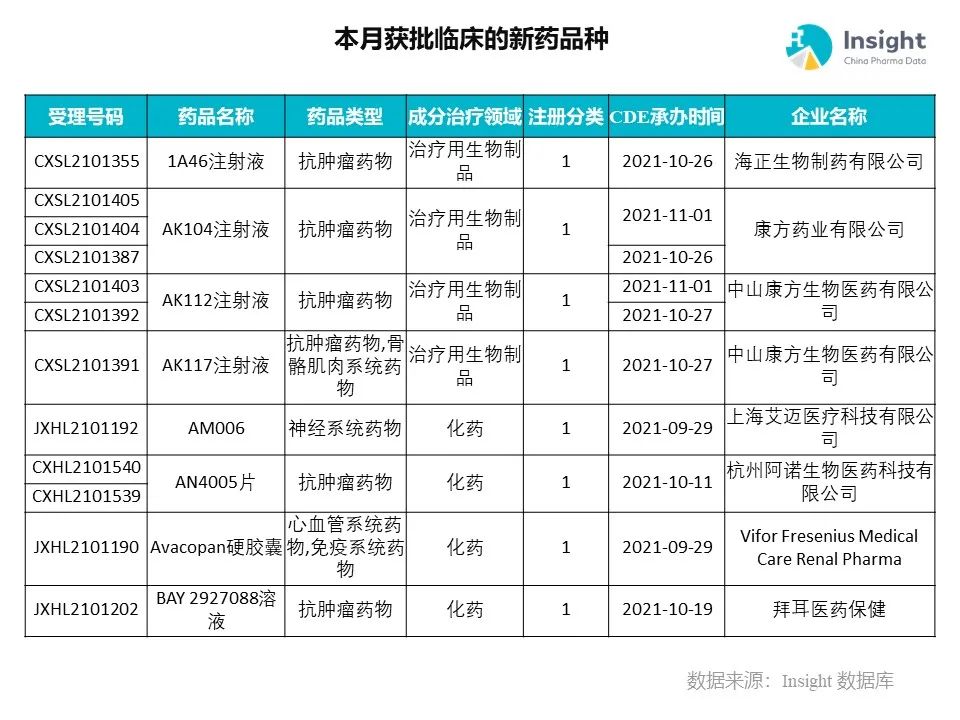
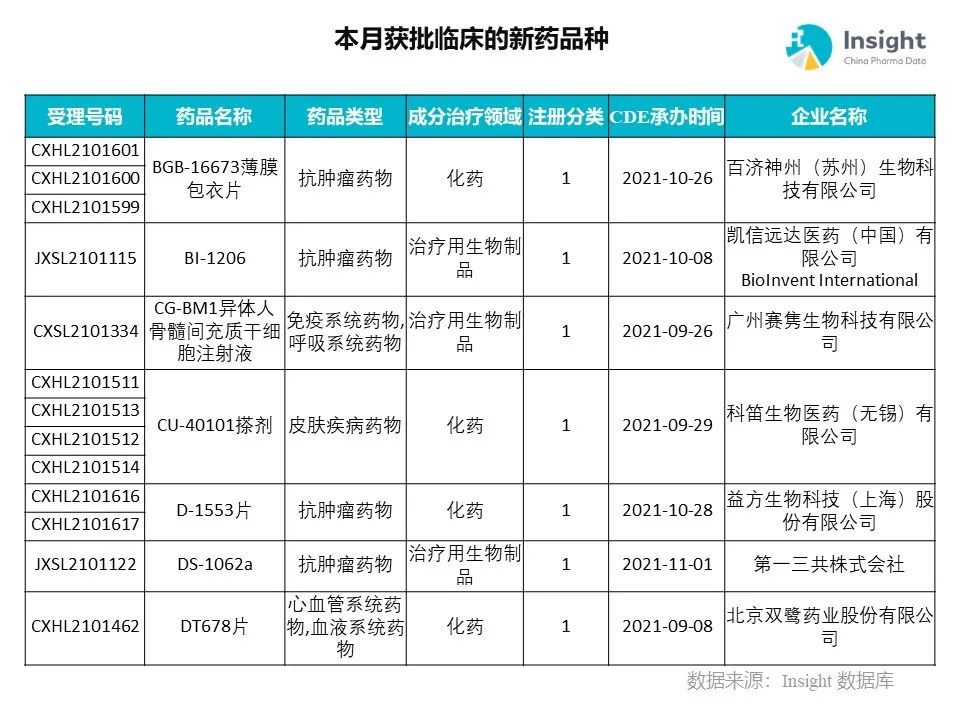
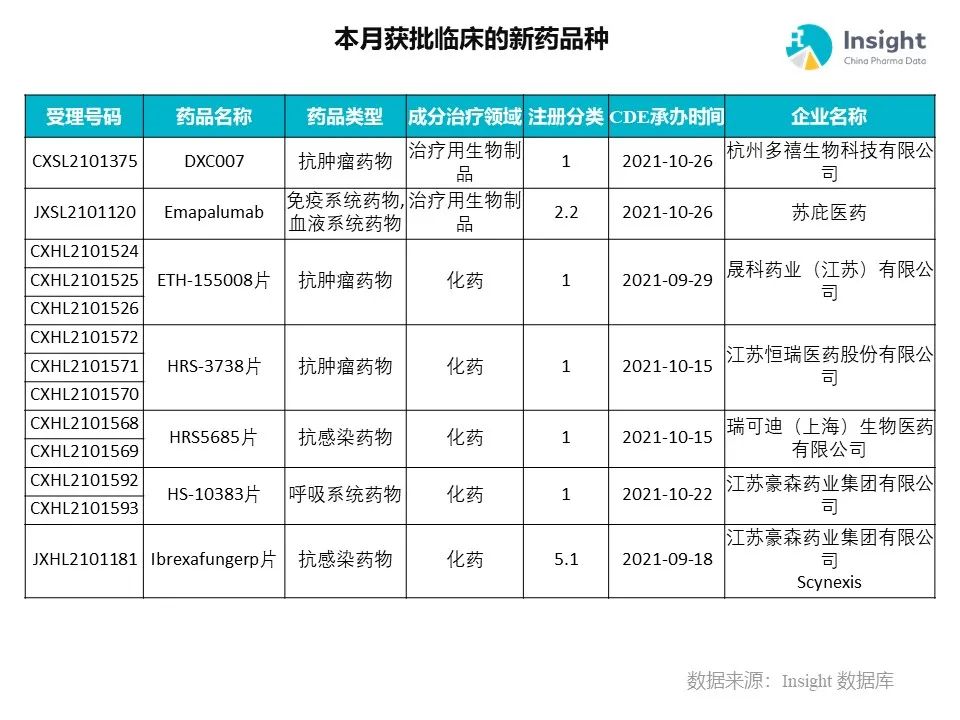
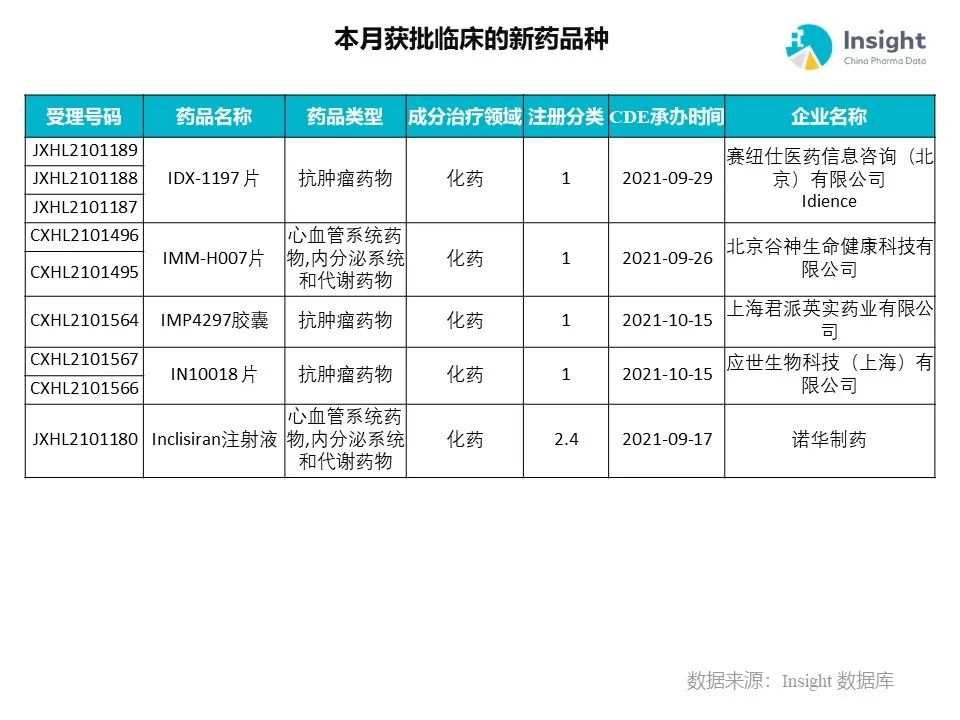
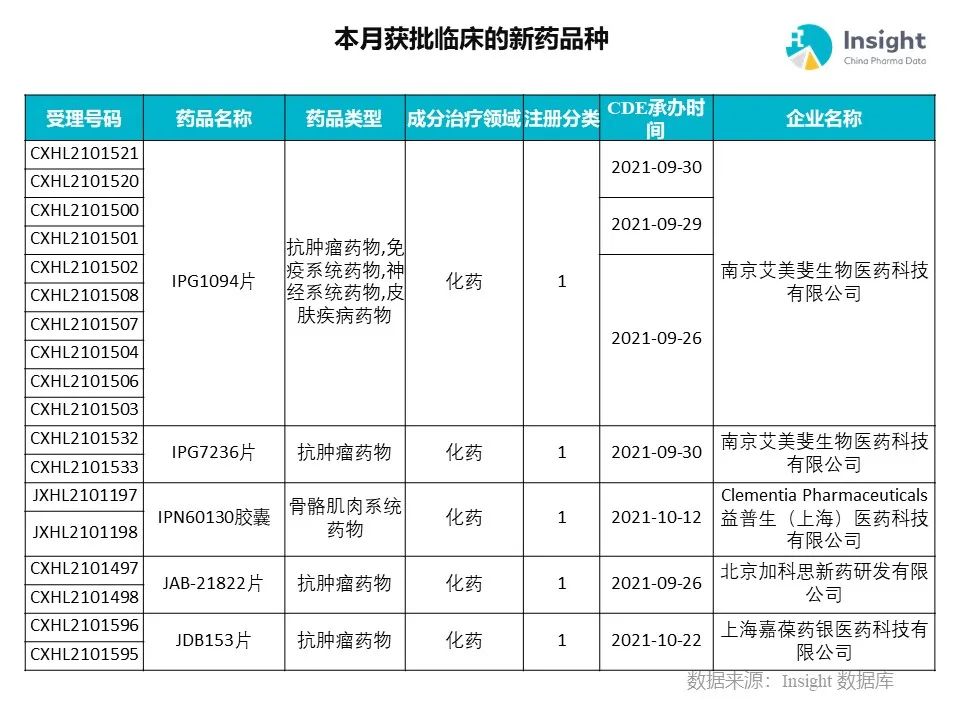
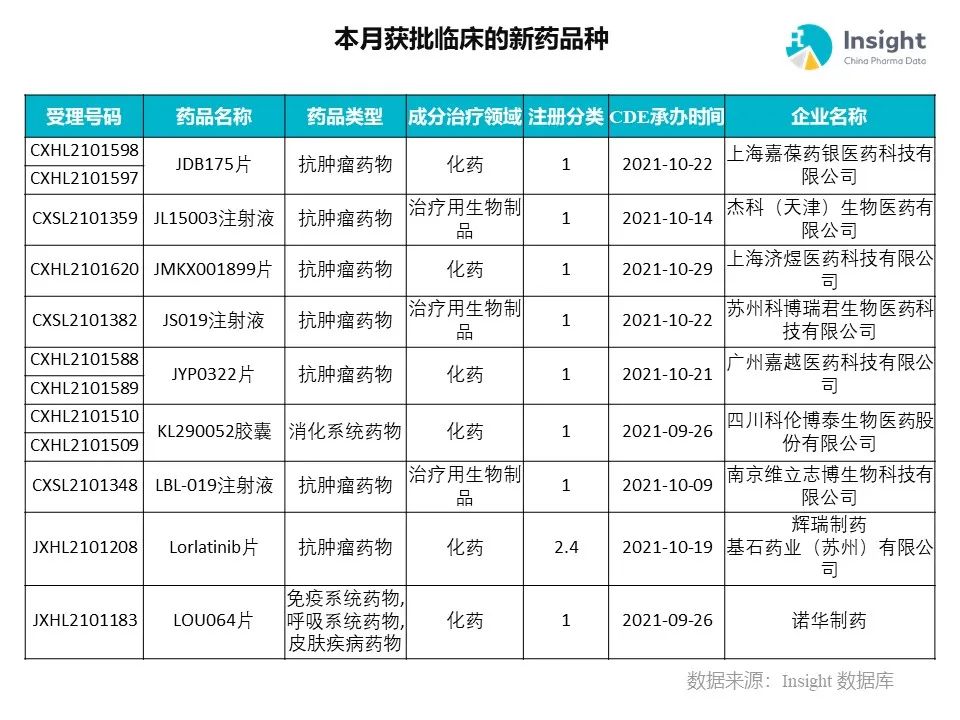
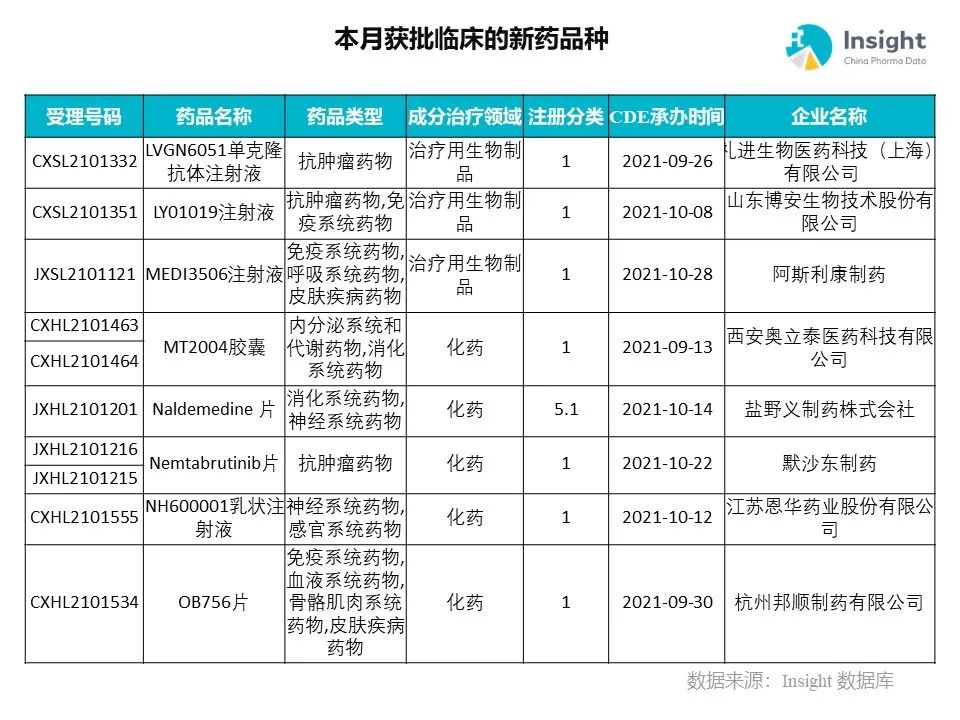
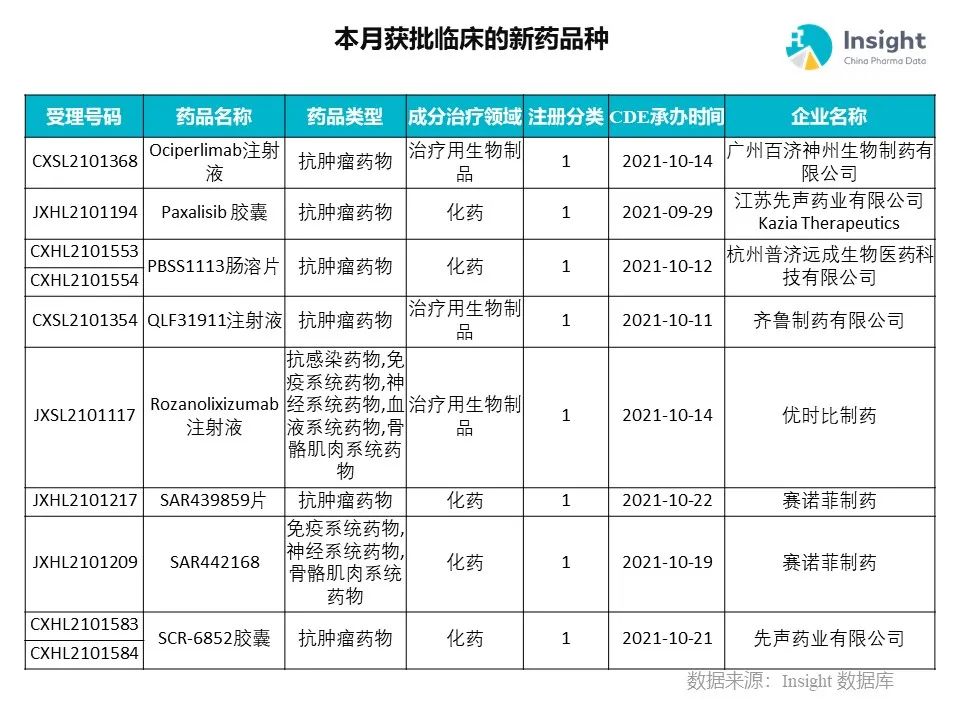
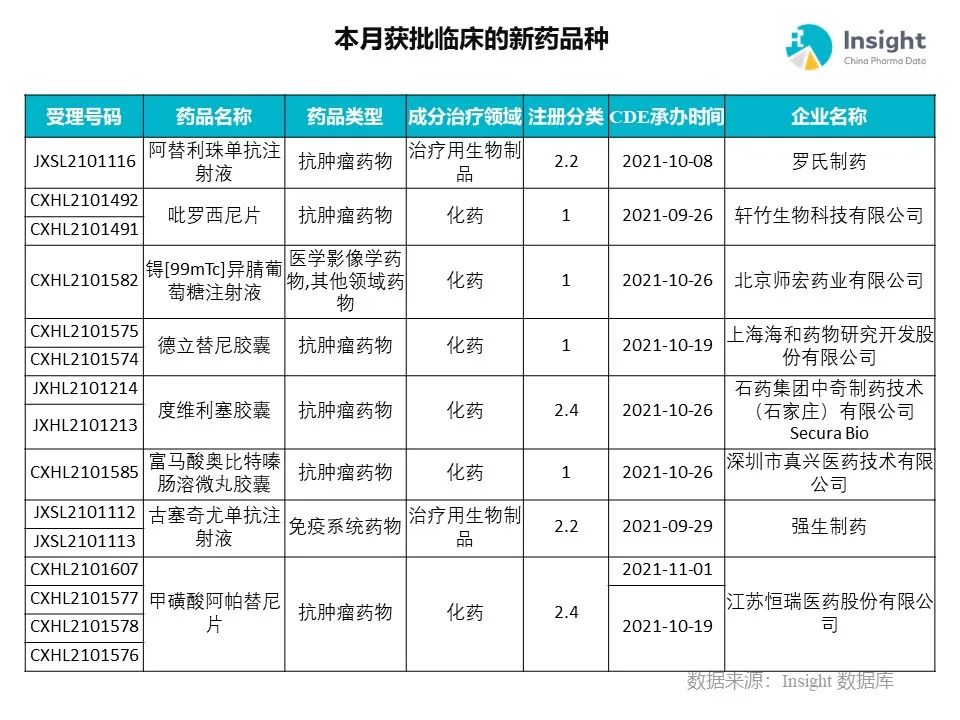
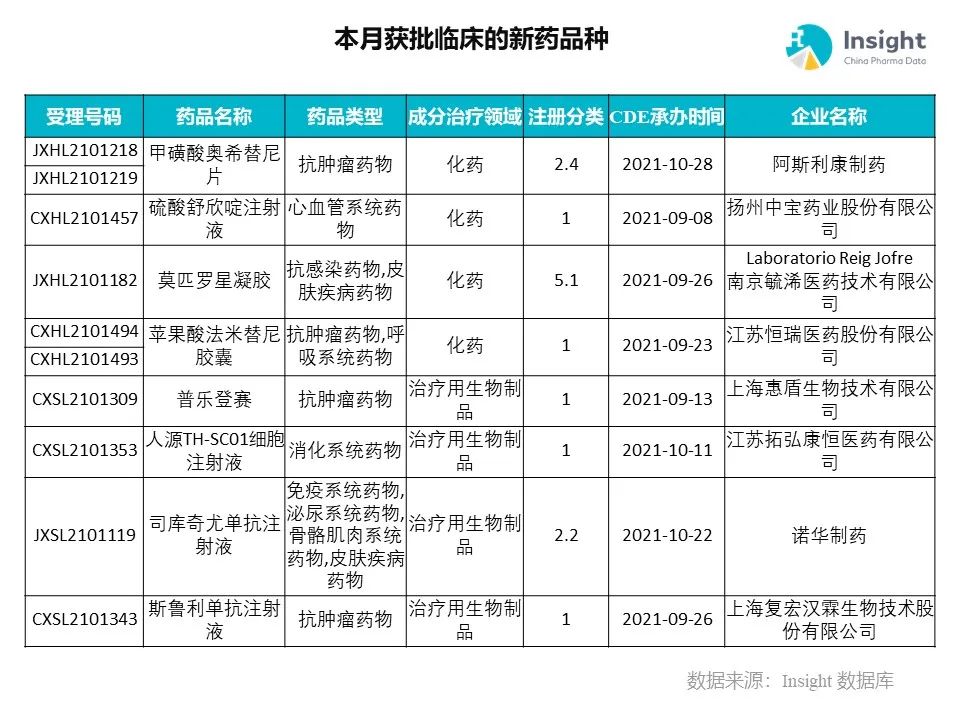
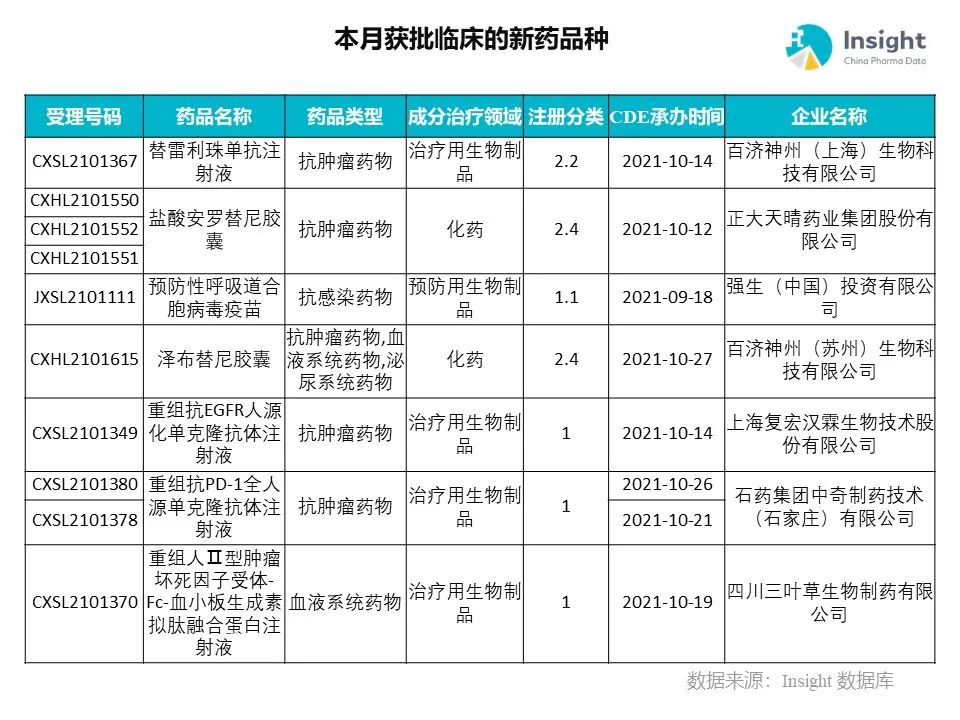
下面是本月获批临床品种的部分重点产品介绍,文章略长,可选择性阅读。

获批临床新药品种介绍
12 月新药获批临床的受理号共 200 个,涉及 123 个品种,部分产品介绍如下。
药品名称:AN4005 片
企业名称:阿诺医药
AN4005 是阿诺医药开发的一款口服活性的特异性 PD-L1 拮抗剂,将在中国开展治疗晚期肿瘤患者的开放、多中心、1 期研究。不同于已经获批的抗 PD-(L)1 抗体,AN4005 是一款可口服用药的 PD-L1 小分子抑制剂
药品名称:Avacopan 硬胶囊
企业名称:Vifor Pharma
由 Vifor Pharma 申报的 Avacopan 硬胶囊获得一项临床试验默示许可,适应症为:抗中性粒细胞胞浆抗体相关性血管炎成人患者的治疗。公开资料显示,Avacopan 是一款口服给药的选择性补体 C5a 受体抑制剂,已经在日本和美国获批。
药品名称:BGB-16673 薄膜包衣片
企业名称:百济神州
百济神州的 BGB-16673 薄膜包衣片已在国内获批临床。公开资料显示,BGB-16673 是一款靶向 BTK 的蛋白降解剂,这是国内第二款申报临床的 BTK-PROTAC,也是百济神州首个基于其蛋白降解 CDAC 技术平台开发且进入临床阶段的在研产品。
药品名称:DT678 片
企业名称:双鹭药业
DT678 片为 P2Y12 受体拮抗剂,通过抑制 ADP 与血小板 P2Y12 受体的结合,从而抑制血小板聚集,预防血栓形成。DT678 片是全球首创的抗血小板聚集用药领域的创新药,由美国密歇根大学参股的 DT 公司(双鹭药业持有 30% 股权)与双鹭药业共同开发,双鹭药业拥有该专利化合物在中国的独家开发使用权。
药品名称:Ibrexafungerp 片
企业名称:翰森制药
翰森制药高价引进的广谱抗真菌药物 Ibrexafungerp 片获批 III 期临床,用于治疗外阴阴道念珠菌病。Ibrexafungerp 是一款全球首创、作用机制全新的新型三萜类结构的糖原合成酶抑制剂,具有广谱的抗真菌活性。
药品名称:IPG1094 片
企业名称:艾美斐生物
IPG1094 是由艾美斐自主研发的「First-in-Class」药物,靶向 MIF,在临床前研究中显示对多种实体肿瘤,多发性骨髓瘤以及银屑病、红斑狼疮、多发性硬化症等自身免疫性疾病具有良好治疗作用,同时在渐冻症、阿尔茨海默病方面也有非常好的疗效。同时,IPG1094 也有与其它药物联用的潜能。
药品名称:IPG7236 片
企业名称:艾美斐生物
艾美斐 IPG7236 片临床试验获得批准,用于治疗实体瘤。这是国内首款进入临床的 CCR8 抑制剂。临床前研究显示,IPG7236 能高效阻断肿瘤微环境中 Treg II 浸润、扩增、降低其免疫抑制性,具有广谱抗肿瘤作用,且安全性极高。
药品名称:JDB153 片、JDB175 片
企业名称:嘉葆药银
嘉葆药银自主研发的一类小分子创新药 JDB175 片和 JDB153 片分别获批临床,拟适应症为弥漫性大 B 细胞淋巴瘤和晚期实体瘤。JDB153 是全球首个 MNK 和 VEGFR 双靶点抑制剂,有望为病人提供全新机制的有效安全治疗选择,具有重要的临床价值和社会意义。JDB175 是一个具有高选择性的第二代 BTK 口服抑制剂,与同类药物相比,具有良好的 BTK 选择抑制性,且安全性与耐受性表现良好。
药品名称:JL15003 注射液
企业名称:杰科生物
杰科生物 JL15003 注射液首次在中国获得临床试验默示许可,适应症为:拟用于治疗复发胶质母细胞瘤。根据杰科生物公开资料,JL15003 为溶瘤病毒产品,也是公司首个获批临床的 1 类新药。
药品名称:LBL-019 注射液
企业名称:维立志博生物
LBL-019 是维立志博第 5 个获得临床试验许可的肿瘤免疫 2.0 抗体,具有区别于 PD-1/PD-L1 抗体的独特的抗肿瘤机制。是一种高亲和力抗 TNFR2 人源化单克隆抗体,其作用靶点明确,选择特异性高。
药品名称:MEDI3506 注射液
企业名称:阿斯利康
阿斯利康申报的 MEDI3506 注射液获得一项临床试验默示许可,适应症为慢性阻塞性肺病患者的附加维持治疗。公开资料显示,MEDI3506 是一款可抑制 IL-33 功能的单克隆抗体。
药品名称:MT2004 胶囊
企业名称:奥立泰医药
MT2004 为安奥立泰医药开发,采用特定的化学修饰手段使其靶向肝脏并特异性地激活 FXR 受体。该产品已在美国完成 1 期临床研究,证明其对 FXR 受体的激动作用,且安全性良好,即将进入临床 2 期研究。此次该药在中国获批临床研究的适应症为:非酒精性脂肪性肝病,将开展 1 期桥接临床试验。
药品名称:Nemtabrutinib 片
企业名称:默沙东制药
由默沙东申报的 Nemtabrutinib 片获得两项临床试验默示许可,适应症为血液系统恶性肿瘤。这是一款第二代 BTK 抑制剂,由默沙东 27 亿美元收购 ArQule 公司所得。
药品名称:Ociperlimab 注射液
企业名称:百济神州
百济神州的 ociperlimab 注射液获批临床,适应症为联合替雷利珠单抗注射液或利妥昔单抗注射液用于弥漫性大 B 细胞淋巴瘤。该产品为公司自主研发的一款强效、具完整 Fc 段功能的在研抗 TIGIT 抗体。
药品名称:Paxalisib 胶囊
企业名称:先声药业
先声药业与 Kazia Therapeutics 达成超 2.9 亿美元合作,引进 Paxalisib 胶囊在大中华地区所有适应症的开发和商业化的权益。本次获批在中国开展针对新确诊和复发性 GBM 的 2/3 期临床研究,旨在评估多个治疗方案的疗效,以支持该适应症在中国的获批。
药品名称:QLF31911 注射液
企业名称:齐鲁制药
QLF31911 注射液是齐鲁制药开发的创新型生物大分子,可用于治疗包括血液瘤和实体瘤在内的多种恶性肿瘤,为齐鲁制药肿瘤免疫产品线中极具竞争力的品种。
药品名称:SAR439859 片
企业名称:赛诺菲制药
SAR439859 是赛诺菲开发的一款在研小分子靶向疗法,属于口服选择性雌激素受体降解剂。该药可通过与乳腺癌细胞中的雌激素受体结合,引发其降解。早前,该药已在中国获批一项针对「已接受过激素疗法的绝经前和绝经后雌激素受体阳性、HER2 阴性、局部晚期或转移性乳腺癌患者」的临床研究。
药品名称:SCR-6852 胶囊
企业名称:先声药业
SIM0270 是先声药业研发的具有自主知识产权的全新结构口服 SERD 化合物,日前获批临床。作为全球同类在研 SERD 药物中目前唯一可以有效透过血脑屏障的分子,SIM0270 有望为乳腺癌脑转移患者提供新的治疗选择。
药品名称:SH009 注射液
企业名称:圣和药业
圣和药业自主研发的靶向 CD47/PD-L1 双抗产品 SH009 注射液获批临床,适应症为晚期恶性肿瘤。该产品一方面能阻断 CD47-SIRPα信号通路,可以在体内外提高巨噬细胞对肿瘤细胞或肿瘤细胞碎片的吞噬作用;另一方面能阻断 PD-1/PD-L1 信号通路,可以在体内外提高肿瘤特异性 T 细胞的增殖、细胞因子分泌和杀伤肿瘤细胞的能力。
药品名称:SSGJ-706 注射液
企业名称:三生国健
SSGJ-706 是三生国健利用自主知识产权双特异抗体平台开发的一种重组双特异抗体,可同时结合两个和肿瘤免疫抑制功能密切相关的靶点,从而更有效地促进 T 细胞活化和增殖,进一步增强其肿瘤杀伤活性。其药效学研究证实了 SSGJ-706 在多种移植瘤中的抗肿瘤疗效。
药品名称:TCR1672 片
企业名称:泰德制药
TCR1672 是由泰德医药自主研发的二代高选择性的 P2X3 受体拮抗剂,目前主要应用于治疗呼吸领域的难治性慢性咳嗽成年患者及疼痛领域的子宫内膜异位症等复杂性内脏痛患者。这是国内第二款进入临床阶段的国产 P2X3 受体拮抗剂。
药品名称:TST005 注射液
企业名称:迈博斯生物
TST005 由高亲和力抗 PD-L1 抗体和融合在其 C 端的经工程改造的 TGF-β受体 II 型蛋白组成,具有对 T 细胞杀伤风险更低、脱靶毒性更低的特点,是一个具有潜在更好治疗窗口的双功能抗体。
药品名称:TT-01688-CL 片
企业名称:药捷安康
TT-01688 是韩国 LG Chem 旗下生命科学公司开发的一款 S1P1 受体调节剂。2021 年 4 月,药捷安康获得了这款自身免疫性疾病治疗产品在大中华地区所有适应症的开发及商业化独家许可权益。LG Chem 已经在韩国完成该产品的临床 1 期研究。此次,其在中国获批的临床研究适应症为:拟用于治疗中重度活动性溃疡性结肠炎。
药品名称:VIC-1911 片
企业名称:捷思英达
由捷思英达申请的 VIC-1911 片获得两项临床试验默示许可,适应症为晚期卵巢癌。VIC-1911 是一款新一代高选择性的 Aurora A 激酶抑制剂,由 Taiho Pharmaceutical 公司研发,2020 年 6 月,捷思英达子公司 Vitrac Therapeutics 引进了该产品在肿瘤领域的全球独家开发和商业化权利,并协议由捷思英达负责该产品在大中华区域肿瘤领域的开发和商业化。
药品名称:ZG005 粉针剂
企业名称:泽璟生物
ZG005 是重组人源化抗 PD-1/TIGIT 双特异性抗体粉针剂,为创新型肿瘤免疫治疗生物制品,有望用于治疗多种实体瘤。根据公开查询,ZG005 是全球率先进入临床研究的同靶点药物之一,目前全球范围内尚未有同类机制药物获批上市。
药品名称:ZX-101A 胶囊
企业名称:征祥医药
ZX-101A 是安全窗口明显改进的新一代 PI3Kδ/γ双靶点抑制剂,在抑制靶点蛋白的同时通过免疫调节改善肿瘤微环境。已于 2020 年 6 月获得 FDA 的临床许可,目前正在开展血液肿瘤的临床研究。此次其在中国获得四项临床试验默示许可,适应症为晚期实体瘤和复发/难治性血液系统恶性肿瘤
药品名称:注射用 BGC0228
企业名称:博瑞生物
注射用 BGC0228 即是博瑞医药基于 ADC 的概念原创设计的一款靶向高分子偶联药物,以高分子靶头取代抗体,通过肽链结合传统细胞毒药物形成新的化合物,实现了精准连接不脱落,分子量比 ADC 药物更小,从而能顺利渗透肿瘤细胞,进入肿瘤细胞组织内释放药物,达到杀死肿瘤的目的。此次其在中国获批的临床研究适应症为:晚期恶性实体瘤。
药品名称:注射用 MRG002
企业名称:美雅珂生物
乐普生物子公司美雅珂生物的注射用 MRG002 获得一项临床试验默示许可,适应症为晚期恶性实体瘤。据乐普生物此前新闻稿,MRG002 是美雅珂生物开发的一款靶向 HER2 的 ADC,目前该产品正在全球范围内展开多个适应症的临床研究。
▲以上数据来源于 Insight 申报进度数据库
本报告在每月 11 号左右定期发布,敬请期待。以上品种介绍根据企业公开披露信息整理。

推荐阅读
点击阅读原文
申请试用数据库





 个人中心
个人中心
 我是园区
我是园区




