
导读:崔霁松博士和施一公博士联合创办,诺诚健华申报科创板IPO!
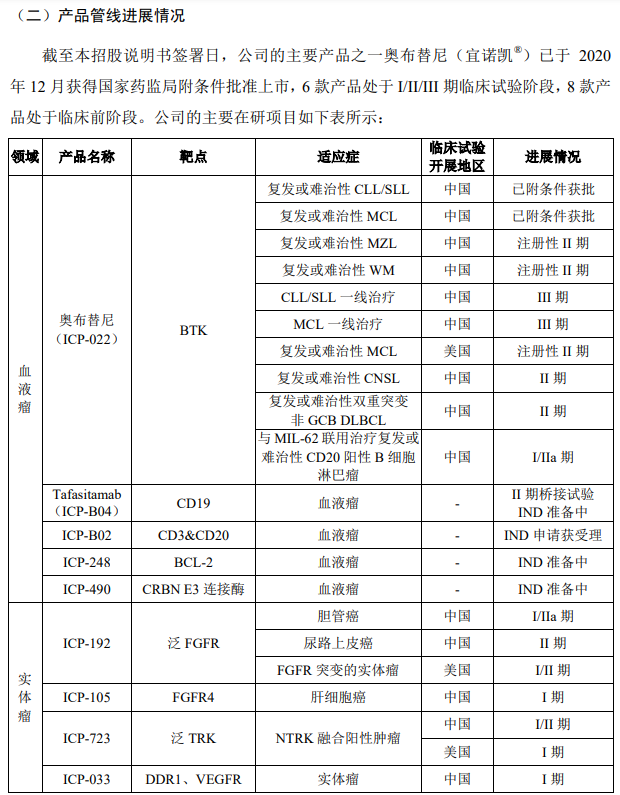
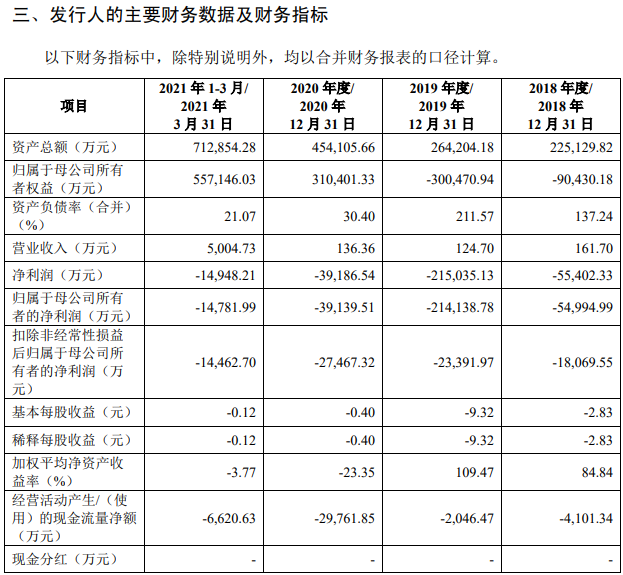
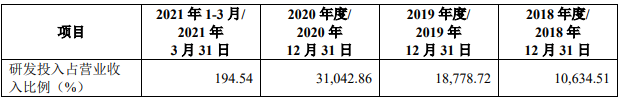
报告期内,公司投入大量资金用于产品管线的临床前研究、临床试验及新药上市前准备。2018 年度、2019 年度、2020 年度和2021 年 1-3 月研发费用金额分别为 17,195.53 万元、23,417.30 万元、42,330.60 万元和 9,736.06 万元。截至本招股说明书签署日,公司有 1 款产品上市销售,6 款产品处于 I/II/III 期临床试验阶段,8 款产品处于临床前阶段。


四、发行人的主营业务情况
公司是一家以卓越的自主研发能力为核心驱动力的创新生物医药企业,拥有全面的 研发和商业化能力,专注于肿瘤和自身免疫性疾病等存在巨大未满足临床需求的领域, 在全球市场内开发具有突破性潜力的同类最佳或同类首创药物。
公司拥有兼具国际创新视野与深刻行业洞察的创始团队和管理团队。公司的创始团 队已长期合作多年,彼此专业互补且配合默契,共同推进公司高效快速发展。公司的联 合创始人为 Jisong Cui(崔霁松)博士和施一公博士,Jisong Cui(崔霁松)博士曾担任 保诺科技(北京)有限公司的总经理及美国默克(Merck & Co.)的早期开发团队的负 责人,施一公博士是知名的结构生物学家,现为中国科学院院士、美国艺术与科学院外 籍院士、美国国家科学院外籍院士、欧洲分子生物学组织(EMBO)外籍成员、西湖大 学创始校长、清华大学生命科学学院讲席教授等。公司的主要管理团队成员拥有辉瑞 (Pfizer Inc.)、葛兰素史克(GlaxoSmithKline plc)、百时美施贵宝(Bristol-Myers Squibb Company)、强生公司(Johnson & Johnson)等大型跨国药企的资深工作经验,在创新 药研发、生产和商业化等各个环节为公司注入远见卓识。
在具有丰富研发、生产和商业化经验的管理团队的带领下,公司已构建起一体化的 生物医药平台,兼顾研发质量与研发速度的需求,建立了创新性与风险高度平衡、涵盖 多个极具市场前景的热门靶点的产品管线,正加速成长为为全世界肿瘤和自身免疫性疾 病患者开发并提供创新疗法的生物医药领导者。截至本招股说明书签署日,公司的主要 产品之一奥布替尼(宜诺凯®)已于 2020 年 12 月获得国家药监局附条件批准上市,6 款产品处于 I/II/III 期临床试验阶段,8 款产品处于临床前阶段。公司正在以中美两地为 主的全球市场快速推进在研产品的临床试验与注册申报工作,以实现产品管线中的候选 药物早日造福全球患者。
公司的产品布局聚焦于具有广阔市场空间的肿瘤与自身免疫性疾病领域,侧重于构 建具有协同效应的创新疗法。在血液瘤方面,公司拥有奥布替尼(BTK 抑制剂)、ICP-490(CRBN E3 连接酶调节剂)和 Tafasitamab(靶向 CD19 的单克隆抗体)等具备高度差 异化竞争优势及协同效应的血液瘤治疗产品,其中奥布替尼已获得国家药监局附条件批 准上市用于治疗复发或难治性 CLL/SLL 以及复发或难治性 MCL;在实体瘤方面,公司 拥有 ICP-192(泛 FGFR 抑制剂)、ICP-723(泛 TRK 抑制剂)、ICP-189(SHP2 抑制剂) 等产品,覆盖多种实体瘤治疗机制;在自身免疫性疾病方面,公司正在开发用于治疗由 B 细胞或 T 细胞功能异常所导致的自身免疫性疾病的多款产品,包括奥布替尼(BTK 抑制剂)、ICP-332(TYK2-JH1 抑制剂)和 ICP-490(CRBN E3 连接酶调节剂)等。除 单药疗法外,公司也积极挖掘在研产品与标准疗法或其他疗法联合用药的潜力。
在新药发现与开发方面,公司始终坚持将自主创新作为可持续发展的引擎,已构建 起化合物优化平台、药物晶型研究平台和难溶性药物增溶制剂技术研发及产业化平台:(1)化合物优化平台能够基于蛋白-药物分子的三维晶体结构加速高成药性化合物的发 现;(2)药物晶型研究平台能够用于确定具有优势晶型的原料药并支持稳定性研究;(3) 难溶性药物增溶制剂技术研发及产业化平台能够解决当前创新药普遍存在的制剂瓶颈 问题,有效增加候选药物的生物利用度。公司在北京、南京及广州分别设有一流的研发 中心,能够自主开展化学、生物学、药理学、药代动力学、毒理和 CMC 研究以及药物 晶型研究与开发等工作。此外,由施一公博士领衔的科学顾问委员会能够凭借其深厚的 学术洞见帮助公司显著提高基于基因组学和蛋白质结构的药物设计能力与新靶点发现 能力。
在临床研究方面,公司已打造一支兼具优秀的方案设计能力、高效的执行力与监管 机构沟通能力的以中美两地为核心的临床开发及注册团队。凭借对产品差异化特性的深 刻理解和对临床机会的敏锐捕捉,公司充分挖掘在研产品针对多种适应症的治疗潜力, 并在全球范围内采取最优的注册申报策略加速产品获批上市,确保临床前表现优异的候 选产品在临床试验阶段得到有效评估。同时,公司还建立起基于生物标志物的转化医学 研究平台,有效评估临床试验数据,提高药物研发效率。截至 2021 年 3 月 31 日,公司 正在全球 100 多个临床中心开展超过 15 项临床试验。
在生产方面,截至 2021 年 3 月 31 日,公司已在广州基本完成生产基地一期项目建 设,该基地按照中国、美国、欧盟及日本等国家的 GMP 标准建设,可用于生产固体分 散体和多种制剂,年生产能力预计可达 10 亿片量级。该生产基地正在进行奥布替尼片 生产准备,预计于 2021 年下半年完成检测方法、工艺转移和相关验证工作,2022 年上半年完成相关药品监管部门的检查并投入生产,正式投产后将有效保证公司产品的质量 与供应。同时,为加速商业化进程,公司与优质的 CMO 合作,在商业化的早期阶段为 公司已上市产品奥布替尼片的生产提供支持。
在商业化方面,截至 2021 年 3 月 31 日,公司已覆盖全国数百家医院,快速推动奥 布替尼在 B 细胞淋巴瘤的市场拓展。奥布替尼已被纳入 2021 版《CSCO 淋巴瘤诊疗指 南》,被列为复发或难治性 CLL/SLL 和复发或难治性 MCL 治疗的 I 级推荐方案。同时, 公司积极探索多元化的创新业务模式、支付手段及多地商业保险,截至本招股说明书签 署日,奥布替尼已被纳入北京市、上海市、四川省成都市、浙江省舟山市和衢州市、山 东省临沂市、广东省珠海市、惠州市和佛山市、江苏省苏州市、云南省昆明市等 20 个 省市的政府指导地方商保。公司正在积极参加 2021 年国家医保谈判,全力提升奥布替 尼的患者可及性。
参考来源:招股说明书(申报稿)



 个人中心
个人中心
 我是园区
我是园区




