近日,CASI Pharmaceuticals, Inc.(纳斯达克股票代码:CASI)和BioInvent International AB(纳斯达克斯德哥尔摩:BINV)宣布,在中国首次进行BI-1206患者1期剂量递增和扩展研究, 与利妥昔单抗联合用于治疗复发/难治性非霍奇金淋巴瘤(NHL)患者。研究设计是评估BI-1206的安全性、耐受性、药理学和临床活性。目前该研究在河南省肿瘤医院开展。
CASI董事长兼首席执行官何为无博士评论说:“我们很高兴在对BI-1206的持续评估中为第一位患者提供剂量。BI-1206先前已显示出令人鼓舞的第1阶段疗效的早期迹象,以及可耐受的安全性,与依赖ADCC(抗体依赖细胞介导的细胞毒性作用)/ CDC(补体依赖的细胞毒性作用)疗效的多种治疗性单克隆抗体一起使用的潜力。在中国进行的这项1期试验将产生有价值的信息,并有可能为复发或难治性NHL患者的治疗提供临床活性的早期证据。
BioInvent首席执行官Martin Welschof表示:“在中国启动这项1期试验是BioInvent的重要里程碑,因为它标志着我们的主要候选药物BI-1206的临床项目的扩展。临床结果非常有希望,我们期待与我们的合作伙伴CASI制药公司一起生成更多数据,以改善NHL患者的治疗”。
关于BioInvent

BioInvent是一家临床阶段的生物技术公司,主要从事发现和开发用于癌症治疗的新型和一流的免疫调节抗体,目前在5个正在进行的临床项目中分别有4种候选药物用于治疗血液癌和实体瘤的1/2期试验。该公司经过验证的专有F.I.R.S.T™技术平台可同时识别靶标和与其结合的抗体,从而产生许多有前途的新候选药物,以推动公司自己的临床开发管道或额外的许可和合作。其中BI-1206是该公司主要产品。
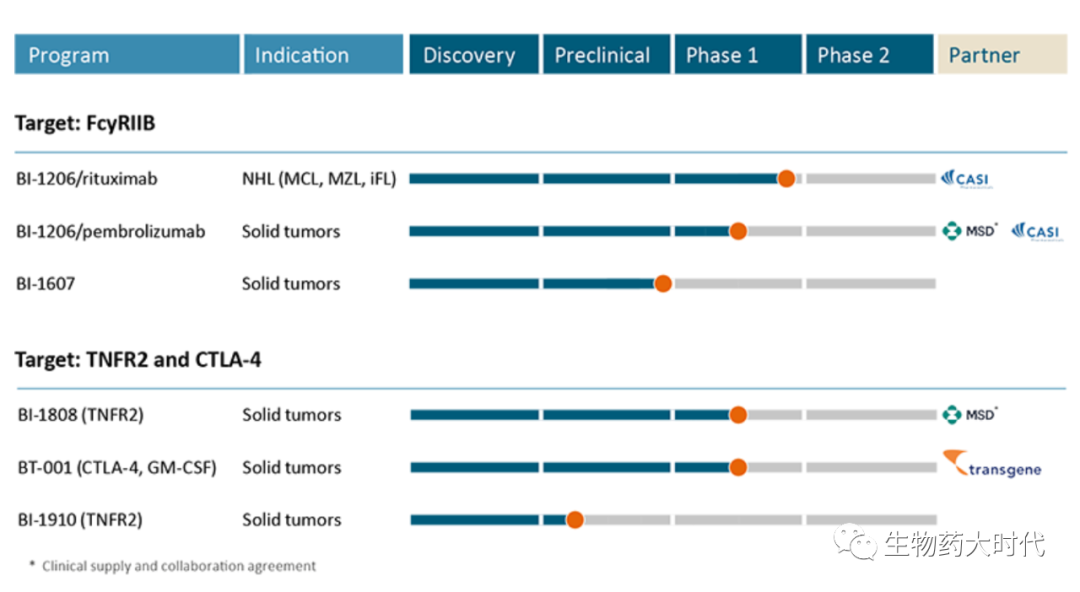
研发管线
关于CASI


研发管线
信息参考:
www.casipharmaceuticals.com
https://bioinvent.com/
END
官方建群啦!
生物药大时代组建了抗体药、疫苗、核酸药物等多个相关领域的实名制微信交流群,扫描下方二维码即可入群!





 个人中心
个人中心
 我是园区
我是园区




