
点评 | Gen-Sheng Feng (加州大学圣地亚哥分校) ,张戈(香港浸会大学),Xu Cao (约翰霍普金斯大学)
强直性脊柱炎(Ankylosing spondylitis, AS)号称“不死的癌症”,是一种以脊柱为主要病变部位的自身免疫性疾病,并可累及骶髂关节,引起脊柱强直。与类风湿关节炎等疾病不同,AS患者炎症与骨侵蚀进展时伴随着异位骨化。当异位骨化形成的骨赘充斥关节腔,进而将关节中两端骨连接可致关节僵硬、脊柱强直和脊柱变形,甚至形成“折叠人”。炎症一直被认为是AS异位骨化的诱因,现有AS治疗药物如非甾体类抗炎药、anti-TNF-α单抗可快速减轻炎症与疼痛,但却不能明显阻止AS患者的骨病变进展【1】。
2021年11月11日,南京大学生命科学学院孙洋/徐强团队和南京市儿童医院风湿免疫科俞海国团队联合在Nature Communications 上发表题为Targeting chondrocytes for arresting bony fusion in ankylosing spondylitis的研究论文【2】,提出异常软骨内骨化是强直性脊柱炎(AS)异位骨赘形成的直接原因,使用Smo抑制剂Sonidegib靶向软骨可显著阻止AS的骨融合进程。

孙洋/徐强教授团队长期探究磷酸酶SHP2在炎症相关疾病中的生物学功能及其作为药物靶标的可行性【3-8】。一次偶然的机会研究人员发现CD4-Cre介导的SHP2条件性敲除小鼠在7月龄以上会出现脊柱、髋关节和骶髂关节等中轴关节变形与僵直症状。Micro-CT分析显示在7月龄后CD4-Cre;SHP2f/f(CD4-CKO)小鼠异位骨化形成骨赘逐渐充斥关节腔并铰链两端骨,导致关节僵直,小鼠12月龄时脊柱、骶髂关节、髋关节和膝关节等大关节均出现骨融合和关节僵直,小鼠活动艰难。
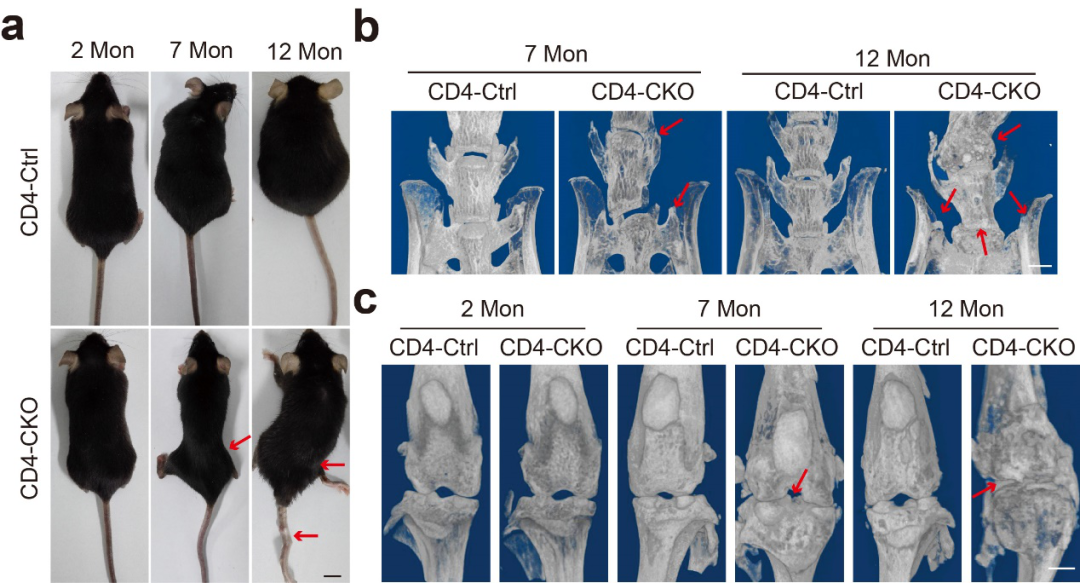
CD4-Cre;SHP2f/f小鼠自发骨病变症状

2月龄:小鼠未发病期;7月龄:小鼠发病早期;12月龄:小鼠发病高峰期
研究人员进而对小鼠自发骨病变的原因进行了探究。通过T细胞转输、骨髓移植以及使用Lck-Cre;SHP2f/f小鼠等实验证实T细胞和其他免疫细胞并不是CD4-Cre;SHP2f/f小鼠骨病变的诱因。使用mTmG荧光示踪技术发现CD4-Cre还介导了一群软骨细胞中SHP2的敲除。SHP2缺失促进软骨细胞增殖分化,导致小鼠骨骺生长板以及起止点等位置软骨细胞异常增殖并分泌BMP6等蛋白促进成骨细胞分化,加剧异位骨化形成。此结果与美国约翰斯霍普金斯大学医学院曹旭教授团队近期在Bone Research【9】发表的AS患者骨切片结果十分一致,均显示异位软骨细胞分化以及Smad1/5信号增强。
由此可见,软骨内成骨在强直性脊柱炎骨赘形成中发挥重要作用,靶向软骨可以作为抑制骨赘形成的新策略。Hedgehog信号通路调控软骨细胞的增殖分化,靶向抑制Hedgehog信号下游Smo可改善软骨瘤。在CD4-Cre;SHP2f/f小鼠发病早期给予Smo抑制剂Sonidegib可显著抑制小鼠异位骨化和骨融合的症状。
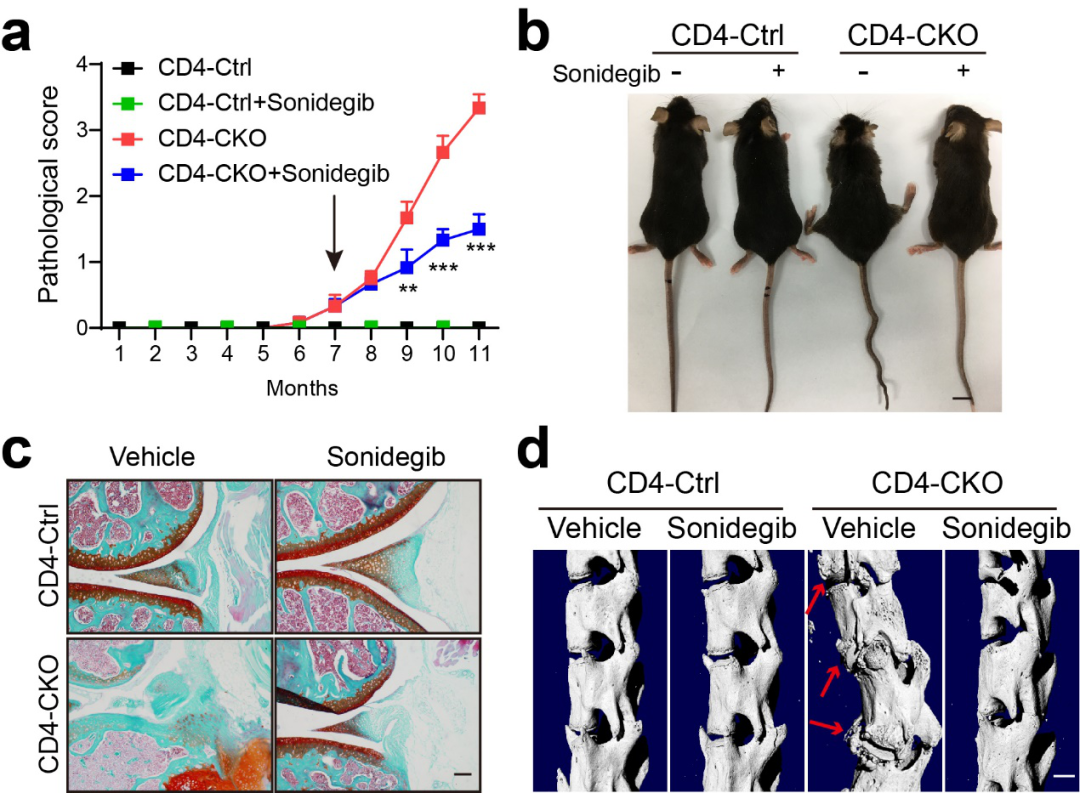
Smo抑制剂Sonidegib抑制骨病变小鼠异位骨化与骨融合进程

相较于骨病变对照小鼠(左下),使用Sonidegib治疗后小鼠(右下)症状显著改善
综上所述,该研究揭示了强直性脊柱炎(AS)铰链骨关节的骨赘是由软骨内成骨所形成,靶向软骨细胞可直接抑制软骨内成骨过程的源头,从而显著改善AS的骨病变进展。
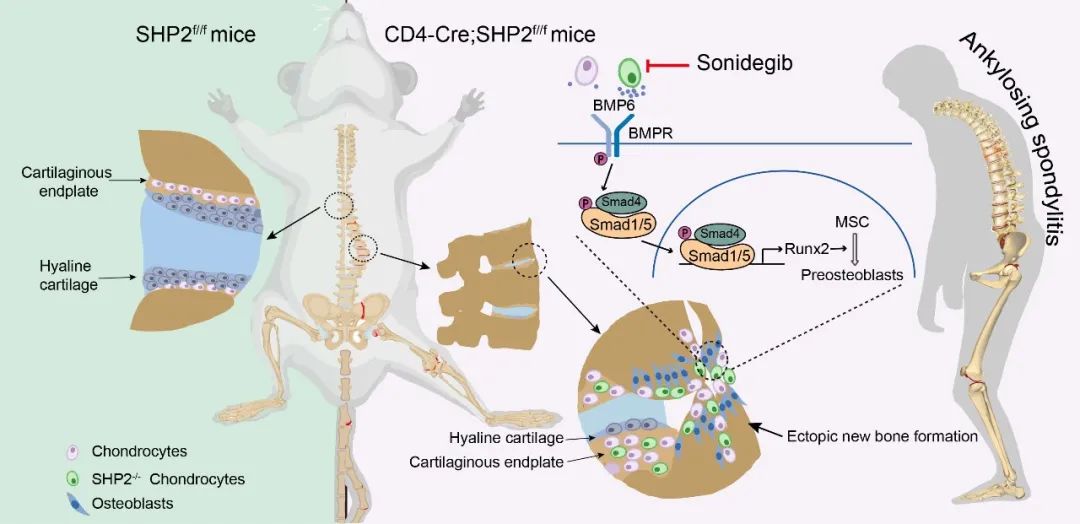
CD4-Cre介导的SHP2条件性敲除小鼠自发骨病变机制
南京大学生命科学学院邵粉丽博士后、刘倩倩博士生和朱雨雨博士以及南京市儿童医院樊志丹博士是该论文的共同第一作者,南京大学生命科学学院孙洋教授、徐强教授和南京市儿童医院俞海国主任为该论文的共同通讯作者。美国加州大学圣地亚哥分校冯根生教授、安捷伦公司宋越博士、南京市儿童医院李小会医生、南京大学生命科学学院华子春教授和郭文洁副教授、江苏省中医院刘史佳研究员和陈文俊副主任医师对该研究亦有贡献。中国科学院分子细胞科学卓越创新中心邹卫国研究员、华东师范大学生命科学学院罗剑教授和中南大学湘雅医院谢辉教授给该研究提供了宝贵建议。
专家点评

Prof. Gen-Sheng Feng (加州大学圣地亚哥分校,美国科学促进会会士 (AAAS fellow)、国际磷酸酶领域知名专家)
小鼠磷酸酶SHP2(编码基因Ptpn11)是1993年Gen-Sheng Feng博士(本研究合作者之一)在加拿大多伦多大学Tony Pawson Lab做postdoc期间首次克隆,至今已近30年,它结构上含有独特的SH2结构域,参与了许多RTK或细胞因子受体的信号传导。越来越多的研究显示,SHP2在多种疾病中扮演着重要的调控作用。目前SHP2是一个非常热门的药物靶点,一系列SHP2变构抑制剂正在开展实体瘤的1-2期临床试验,但这项工作也一定程度上提示了SHP2抑制剂可能存在的副作用。
南京大学孙洋/徐强团队对SHP2在炎症相关疾病中的生物学功能及其作为药物靶标的可行性进行了有意义的探索。近日,该团队从小鼠软骨细胞中SHP2的缺失诱发强直样骨病变的现象出发,揭示了软骨内成骨导致骨融合的崭新分子机制。这是强直性脊柱炎发病机制的一大进展,首次从骨稳态角度展示了强直性骨融合的全过程,并证实靶向软骨细胞Hedgehog信号可抑制软骨内成骨进而阻止强直性骨融合进程。
值得一提的是,目前索尼德吉(sonidegib)作为一种口服Smo拮抗剂,被FDA 批准用于治疗局部晚期基底细胞癌,其安全性已被临床所验证。 通过补充索尼德吉抑制新骨形成能够延缓强直性脊柱炎的骨病变进展,这项研究成果为强直性脊柱炎的治疗提供了一种新的策略,具有潜在的临床应用价值。
专家点评

张戈 教授(香港浸会大学中医药学院副院长、罗守辉骨与关节疾病转化医学研究所副所长、精准医学和创新药物研究所所长)
强直性脊柱炎(AS)是最常见的脊柱关节炎,其特征是炎症和新骨形成。尽管研究人员经过多年的努力,目前对于AS 的发病机制仍不清楚。长期以来,人们对AS的认识大多基于HLA-B27和几种炎症途径。由于难以从患者脊柱关节获取组织,以及缺乏贴近临床表型的理想动物模型,破译新骨形成背后的机制变得异常艰难。
近日,南京大学孙洋、徐强团队发表在Nature Communications的最新工作,通过偶然发现的CD4-Cre条件性敲除SHP2的小鼠出现自发AS样表型(骨变形、骨赘、骨质疏松和骨融合),并以此小鼠为模型揭示了生长板闭合延迟是AS发病的一种崭新机制,CD4-Cre条件性敲除SHP2的小鼠可作为一种新的探究AS发病机制、干预靶标以及药物研发的实验动物模型。
该研究的亮点在于,在前期SHP2抑制软骨细胞增殖分化的基础上进一步发现了SHP2在骨骺生长板发育中的重要作用,SHP2的缺失可致生长板闭合延迟并导致骨稳态失衡。值得一提的是,软骨内成骨过程促进AS中新骨生成的结论与约翰斯霍普金斯大学曹旭教授2021年Bone Research上报道的AS患者骨切片中异位骨化处软骨细胞异常的现象不谋而合,进一步明确了该研究的临床转化意义。
专家点评

Prof. Xu Cao(约翰霍普金斯大学,国际华人骨研协会(ICHTS)现任Chair、美国骨矿研究协会(ASBMR)执行委员会联席Chair、Bone Research创刊主编)
Yang's study provides solid evidence that progression of ankylosing spondylitis is driven by chondrogenesis of heterotopic ossification. Because of the limited understanding of how inflammation induces fusion of axial joints, there is no disease-modifying treatment for ankylosing spondylitis. Their finding of blocking chondrogenesis reduction of ankylosing spondylitis progression has significant clinical implication as chondrogenesis is an essential step of heterotopic ossification. Particularly, we have recently reported, in AS patients, chondrogenesis is also found during progression of ankylosing spondylitis (Yu, T. et al. Chondrogenesis mediates progression of ankylosing spondylitis through heterotopic ossification. Bone Res 9, 2021 https://doi.org/10.1038/s41413-021-00140-6). Targeting chondrogenesis has therapeutic potential for ankylosing spondylitis.
孙洋团队最近的研究提供了坚实的证据,证实强直性脊柱炎的进展是由异位骨化的软骨发生所驱动。由于对炎症如何导致中轴关节骨融合认知有限,目前尚无强直性脊柱炎的特异性治疗方法。孙洋团队的研究发现,软骨形成是异位骨化的关键步骤,通过阻止软骨生成可有效减缓强直性脊柱炎的骨病变进展,这一发现具有重要的临床意义。需要指出的是,我所在的课题组最近的研究发现,在临床强直性脊柱炎患者骨切片上也发现有异位软骨细胞分化增强的现象(Yu, T. et al. Bone Res 2021; 9:19)。综上,靶向软骨生成对强直性脊柱炎骨融合具有治疗潜力。
孙洋团队诚邀优秀博士后、博士和硕士研究生加盟!
包括但不限于具有药理学、病理生理学、分子细胞生物学、生物信息学等相关领域的研究背景;对科学研究有浓厚的兴趣,在炎症、肿瘤、炎癌转化和小分子的化学生物学领域有相关研究经验,大数据、单细胞分析等方面有特长;在专业领域高水平期刊发表过第一或通讯作者(含共同)论文,能够独立开展科研工作,具有良好团队合作和创新进取精神。
简历投递(请申请者将个人简历(PDF文件,包括个人基本情况、教育和工作经历、科研工作介绍、自我评价及其他证明个人能力的相关材料)发至yangsun@nju.edu.cn):https://jinshuju.net/f/ZqXwZt或扫描二维码投递简历。

原文链接:
https://www.nature.com/articles/s41467-021-26750-6
参考文献




 个人中心
个人中心
 我是园区
我是园区




