▎药明康德内容团队报道
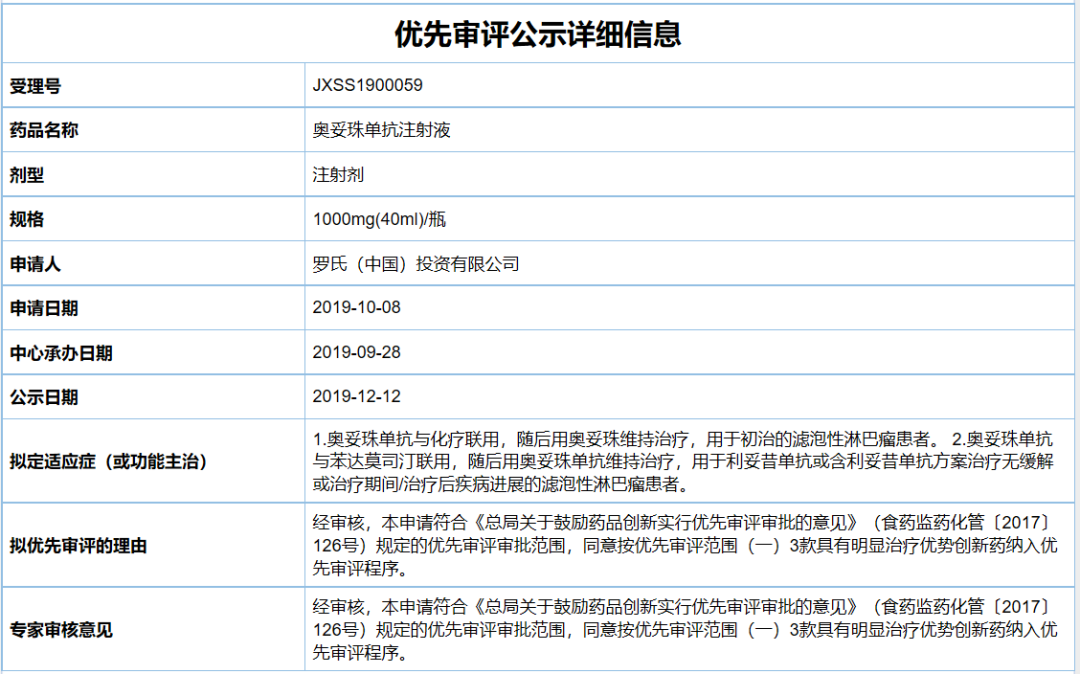
中国国家药监局(NMPA)药品注册进度查询结果显示,罗氏(Roche)提交的第二代CD20单抗奥妥珠单抗注射液(Gazyva,obinutuzumab),其新药上市申请审评状态已更新为:在审批,这意味着这款新药有望于近期在中国获批上市。根据NMPA药品审评中心(CDE)优先审评公示,该上市申请针对的适应症包括初治和经治的滤泡性淋巴瘤患者。
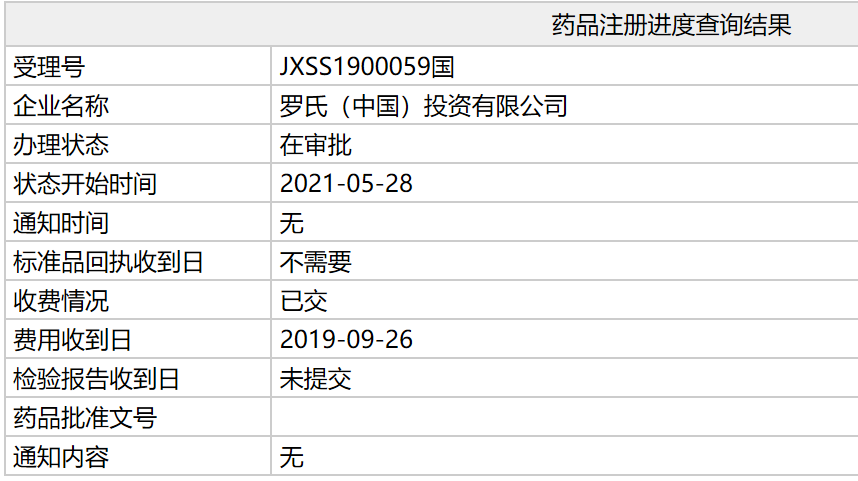
截图来源:NMPA官网
在初治的滤泡性淋巴瘤患者方面,奥妥珠单抗的疗效已在一项名为GALLIUM的全球3期开放性、多中心、随机双臂研究中获得验证。该试验与利妥昔单抗头对头比较了奥妥珠单抗联合化疗、随后单用奥妥珠单抗治疗的疗效和安全性。研究共招募了1385名先前未经治疗的非霍奇金淋巴瘤(NHL)患者,经过中位时间为38个月的观察后发现,奥妥珠单抗治疗方案显著降低疾病恶化或死亡风险28%,且患者具有更优的无进展生存期(PFS)。
在经治的滤泡性淋巴瘤患者方面
,奥妥珠单抗的疗效则在另一项名为GADOLIN的3期研究中得以验证。该试验共纳入321例受试者,数据表明,奥妥珠单抗治疗方案使得患者的无进展生存率改善52%;中位生存期为29.2个月,超过另一组的2倍(13.7个);24.1个月的中位观察期分析表明,奥妥珠单抗治疗方案将患者死亡风险降低了38%。
基于这两项研究的结果,FDA已批准奥妥珠单抗与化疗联合用于先前未经治疗的晚期滤泡性淋巴瘤患者,以及用于经利妥昔单抗疗法治疗后复发/难治性滤泡淋巴瘤患者。这两项适应症,也是奥妥珠单抗在中国申报上市申请针对的适应症,此前该申请还被CDE纳入优先审评。
公开资料显示,奥妥珠单抗是一款对抗体Fc片段进行糖基化改造的第二代CD20人源化单抗,具有很好的清除外周和组织中B细胞的能力。通过靶向通常在特定类型的B细胞表面表达的CD20抗原,它可以直接攻击恶性B细胞,也可以通过自身的免疫系统来发挥功效。此前,它已在美国被批准用于治疗滤泡性淋巴瘤、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)适应症。
其中,滤泡性淋巴瘤(FL)是一种源于B淋巴细胞的惰性非霍奇金淋巴瘤,占所有NHL的20%。FL虽然生长缓慢,但却被认为是一种难以治愈且经常周期性缓解和复发的疾病。患者可能需要多年接受治疗,控制这一慢性疾病的进展。然而对于发生严重感染的患者,临床常用药利妥昔单抗并不适用。
对此,奥妥珠单抗有望改善这一状况。它不仅适用于那些采用利妥昔单抗疗法没有疗效或治疗后淋巴瘤复发的患者,还适用于初治的滤泡性淋巴瘤患者。
我们期待罗氏这款药物在中国早日获批,从而造福更多癌症患者。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局(NMPA)官网. From https://www.nmpa.gov.cn/zwfw/zwfwzhcx/index.html
[2]FDA approves obinutuzumab for previously untreated follicular lymphoma. .Retrieved Nov 16, 2017 from https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm585660.htm
[3]FDA Approves Obinutuzumab for FollicularLymphoma.Cancer Network . Retrieved Feb 26, 2016 from https://www.medscape.com/viewarticle/859545
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。







 个人中心
个人中心
 我是园区
我是园区




