TG Therapeutics近日宣布,美国FDA已加速批准Ukoniq(umbralisib)上市,用于治疗既往接受过至少一种基于抗CD20疗法的复发/难治性边缘区淋巴瘤(MZL)患者,以及既往接受过至少三线全身治疗的复发/难治性滤泡性淋巴瘤(FL)成人患者。新闻稿指出,Ukoniq是首款获批口服PI3Kδ和CK1ε抑制剂。

边缘区淋巴瘤是一组生长缓慢的B细胞非霍奇金淋巴瘤(NHL)。它是第三常见的B细胞NHL,约占所有NHL病例的8%。滤泡性淋巴瘤是最常见的惰性淋巴瘤,约占所有NHL病例的20%。
以往研究表明,PI3Kδ在支持细胞增殖和生存、细胞分化、细胞间运输和免疫中发挥重要作用,在正常和恶性B细胞中均有表达。CK1ε是致癌蛋白翻译的调节因子,与癌细胞(包括淋巴恶性肿瘤)的发生机制有关。Ukoniq曾经获得治疗边缘区淋巴瘤的突破性疗法认定。
这一批准得到了名为UNITY-NHL的开放标签2b期临床试验的支持。在边缘区淋巴瘤(MZL)患者中,Ukoniq达到49%的客观缓解率(ORR),包括16%的完全缓解率,中位缓解持续时间(DOR)尚未达到。在滤泡性淋巴瘤(FL)患者中,Ukoniq达到43%的ORR,中位DOR为11.1个月。
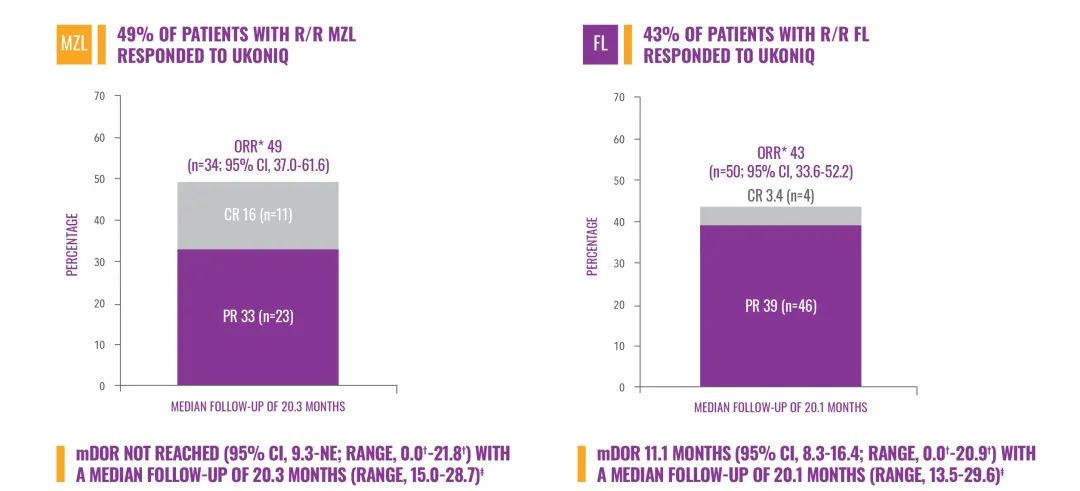
▲Ukoniq在2b期临床试验中的主要疗效终点数据(图片来源:参考资料[1])
日前,美国FDA宣布,批准百时美施贵宝(BMS)旗下Juno Therapeutics公司开发的CAR-T疗法Breyanzi(lisocabtagene maraleucel)上市,用于治疗某些大B细胞淋巴瘤成人患者,这些患者对至少两种其他全身性治疗没有应答,或者在治疗后复发。Breyanzi是一种靶向CD19抗原的CAR-T细胞疗法,它是FDA批准第4款CAR-T疗法。

弥漫性大B细胞淋巴瘤(DLBCL)是世界上最常见的恶性淋巴瘤,也是非霍奇金淋巴瘤(NHL)的侵袭性形式。DLBCL患者中有30%至40%在接受一线治疗后没有得到缓解,或疾病复发。无法接受一线治疗并且不适合高剂量化疗(HDC)和自体干细胞移植(ASCT)的患者预后很差,他们迫切需要更多的治疗选择。
Breyanzi是一款靶向CD19抗原的自体CAR-T疗法。它已经获得美国FDA授予的突破性疗法认定和再生医学先进疗法认定(RMAT)。这款疗法的独特之处在于CAR-T疗法中CD8阳性和CD4阳性T细胞的比例得到控制,从而可以更好地控制细胞疗法的毒副作用。
图片来源:123RF
这一申请是基于名为TRANSCEND NHL 001临床试验中的疗效和安全性数据。该试验结果表明,在可评估的250多名患者中,54%的患者达到完全缓解(CR)。
强生(Johnson & Johnson)公司近日宣布,旗下杨森公司(Janssen)已向美国FDA提交申请,寻求其在研单剂量新冠候选疫苗的紧急使用授权(EUA)。这一EUA申请提交是基于3期临床试验ENSEMBLE的总体有效性和安全性数据,单剂量疫苗达到了试验的所有主要和关键次要终点。

杨森在研新冠疫苗利用了公司的AdVac疫苗平台,该平台也用于开发和制造埃博拉疫苗,以及构建其在研寨卡病毒、呼吸道合胞病毒(RSV)和HIV疫苗。迄今为止,在超过20万人中观察到的安全性特征与使用杨森AdVac技术的其他试验用疫苗一致。
这一在研新冠疫苗与标准疫苗分发渠道兼容。如果获得授权,杨森的在研单剂疫苗估计在-20°C下可保持稳定两年,在2°-8°C的大多数标准冰箱中可以保持稳定3个月。公司将使用与目前标准相同的冷链技术运输疫苗。
此前公布的3期临床试验的结果显示,这一新冠疫苗在单次接种28天之后,对中度和重度COVID-19的预防能力达到66%。同时它预防重度疾病的效力达到85%,并且完全预防COVID-19相关的住院和死亡。

该公司已开始向美国以外的多家监管机构提交滚动申请,并将在未来几周向欧洲药品管理局提交条件性上市许可申请(cMAA)。
日前,德国默克(Merck KGaA)旗下EMD Serono宣布,美国FDA已加速批准口服MET抑制剂Tepmetko(tepotinib)上市,用于治疗携带MET外显子14(METex14)跳跃变异的转移性非小细胞肺癌(NSCLC)成人患者。

肺癌是全球最常见的癌症类型之一,也是癌症相关死亡的主要原因,每年全球有190万死亡病例。MET信号通路的改变,包括METex14跳跃改变,估计在3%-4%的NSCLC病例中发生。
Tepmetko是一种口服MET抑制剂,旨在抑制MET基因变异引起的致癌MET受体信号。它曾经获得美国FDA授予的突破性疗法认定。2020年3月,它被日本厚生劳动省(MHLW)批准治疗METex14跳跃的不可切除、晚期或复发性NSCLC患者。这也是首款MET抑制剂在全球范围内获得监管批准。
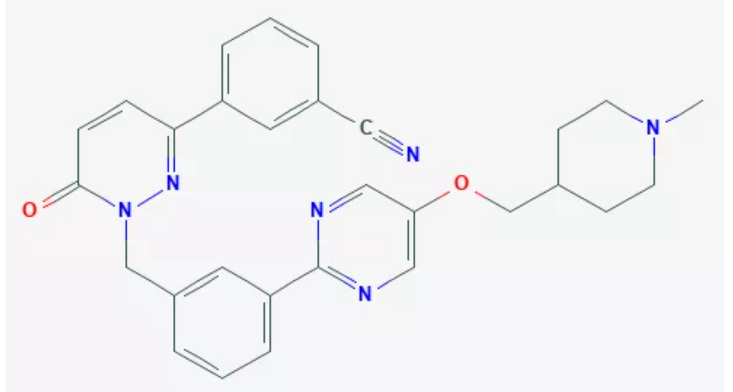
▲Tepotinib分子结构式(图片来源:PubChem)
这一批准,得到了名为VISION的关键性2期临床试验的支持。总计152名携带METex14跳跃变异的晚期或转移性NSCLC患者接受了Tepmetko的单药治疗。他们不携带EGFR或ALK基因突变。
试验结果显示,Tepmetko在初治和经治患者中均达到43%的总缓解率。初治和经治患者的中位缓解持续时间(DOR)分别为10.8个月(95% CI,6.9-NE)和11.1个月(95% CI,9.5-18.5)。67%的初治患者和75%的经治患者的缓解持续时间为6个月以上,30%的初治患者和50%的经治患者的缓解持续时间为9个月以上。
MET已经成为当下癌症领域的热门研究靶点之一。去年5月,FDA加速批准了诺华的MET抑制剂Tabrecta(capmatinib)上市。在中国,虽然尚无针对MET异常相关适应症的药物获批,但已有包括和黄医药、豪森药业在内的十几家企业在进行靶向MET的创新药开发,许多研发项目已经迈入临床阶段。
1.5亿欧元开发下一代mRNA新冠疫苗,葛兰素史克达成合作
近日,葛兰素史克(GlaxoSmithKline,GSK)和CureVac宣布,双方将在现有合作基础上,开展一项新的1.5亿欧元合作,共同开发下一代mRNA新冠疫苗,它有潜力采用多价疫苗策略在一款疫苗中提供对多个新冠突变病毒株的保护。
GSK还将在2021年支持生产高达1亿剂的CureVac第一代新冠候选疫苗CVnCoV。

通过这项独家共同开发协议,GSK和CureVac将为研究、开发和制造新型mRNA候选疫苗贡献资源和专业知识,包括多价和单价策略。这项工作的目的是为各种不同的新冠病毒突变体提供更广泛的保护,并能够对未来可能出现的新变体做出快速反应。开发计划将立即开始,目标是如果获得监管机构批准,在2022年推出疫苗。
新出现变异株的增加有可能降低第一代新冠疫苗的效力,需要加紧努力开发针对变异株的疫苗。下一代新冠疫苗可用于保护之前未接种疫苗的人群,或在初始接种获得的免疫力随时间降低的情况下作为加强免疫。此外,该合作还将评估新型mRNA疫苗的开发,以抵御多种呼吸道病毒。
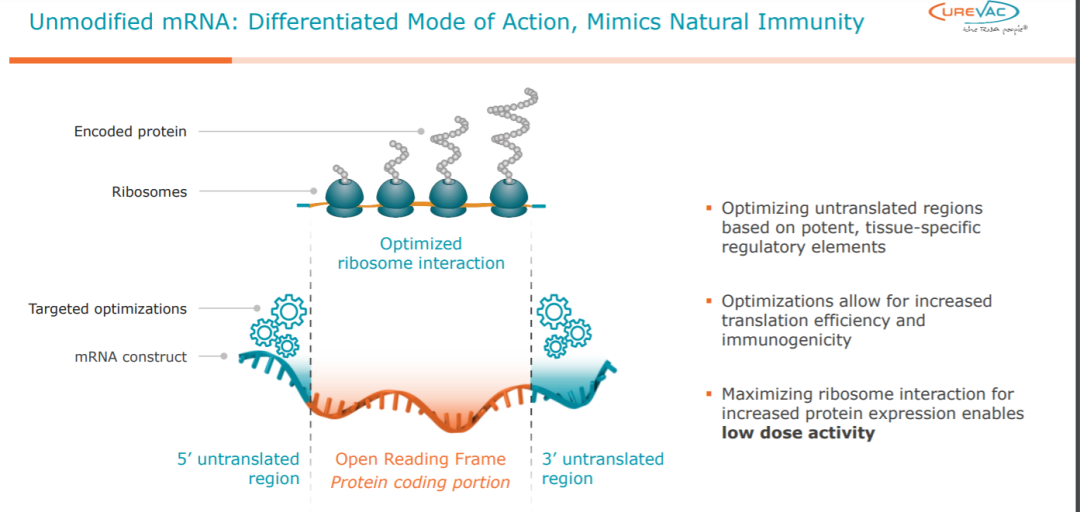
▲CureVac的技术平台能够通过对mRNA序列的优化提高mRNA疫苗的多种特性(图片来源:CureVac官网)
此次合作将建立在CureVac第一代新冠候选疫苗CVnCoV的基础上,该候选疫苗目前正处于2b/3期临床试验阶段。CureVac优化mRNA的能力让它可以激发强力的免疫反应、提高疫苗的可生产性和在标准2-8°C冷链条件下的稳定性。
日前,Horizon Therapeutics和Viela Bio宣布,双方已达成一项协议,Horizon将以大约30.5亿美元的数额,收购Viela Bio。Horizon将收获Viela Bio公司已经获批的抗CD19单克隆抗体Uplizna(inebilizumab-cdon),用于治疗视神经脊髓炎谱系疾病(NMOSD),研发管线中的多款在研疗法,以及Viela Bio在自身免疫性疾病方面的科学专长和生物制品开发方面的深厚经验。

Viela Bio公司在2018年2月获得2.5亿美元A轮融资,从MedImmune独立而出。该公司致力于开发治疗自身免疫性疾病的精准疗法。研发方向主要聚焦于和多种自身免疫性疾病相关的3条生物通路,分别为自身抗体通路,CD40/CD40L共刺激通路,和先天免疫通路。
该公司去年获得批准的Uplizna(inebilizumab-cdon)通过与CD19结合,能够清除产生自身抗体的B细胞。目前,它还在3期临床试验中用于治疗重症肌无力和IgG4相关疾病,并在2期临床试验中用于治疗肾移植脱敏。
该公司的在研疗法VIB4920是一款抗CD40L的融合蛋白,可以阻断CD40/CD40L共刺激通路,目前在2期临床试验中用于治疗干燥综合征,肾移植排斥反应和类风湿性关节炎。
VIB7734是一款旨在清除浆细胞样树突状细胞(pDC)的单克隆抗体。pDC是一种被认为对多种自身免疫性疾病的发病机制至关重要的细胞类型。VIB7734治疗系统性红斑狼疮(SLE)的2期临床试验预计将于2021年上半年开始。
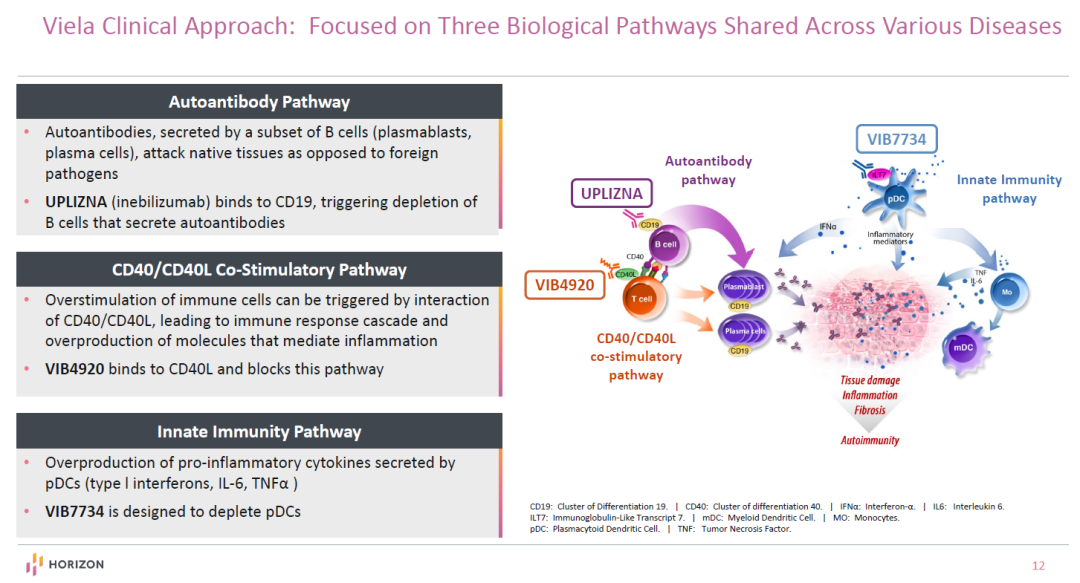
▲Viela Bio公司治疗多种自身免疫性疾病的研发重点(图片来源:参考资料[7])
日前,吉利德科学(Gilead Sciences)公司和Gritstone Oncology联合宣布,双方已达成一项合作和许可协议,合作研发一种基于疫苗的免疫疗法,支持吉利德科学发现HIV感染治愈性疗法的努力。吉利德科学和Gritstone将利用Gritstone专有的疫苗平台开发HIV特异性治疗性疫苗,由自我扩增mRNA(SAM)和腺病毒载体组成,抗原由吉利德科学开发。

激发强有力的CD8阳性T细胞反应是消灭被病毒感染的细胞的关键。Gritstone的独特疫苗平台同时使用了两种不同递送技术来递送抗原。第一次接种使用腺病毒载体,而第二次的增强接种使用可以自我扩增的mRNA。从而避免了腺病毒载体激发的中和抗体对第二次疫苗接种产生影响。 此前的研究已经显示这一平台能够激发大量抗原特异性T细胞的产生。Gritstone过去主要使用这一平台开发抗癌疗法,在今年1月,该公司启动研发项目,使用这一平台开发第二代新冠疫苗。
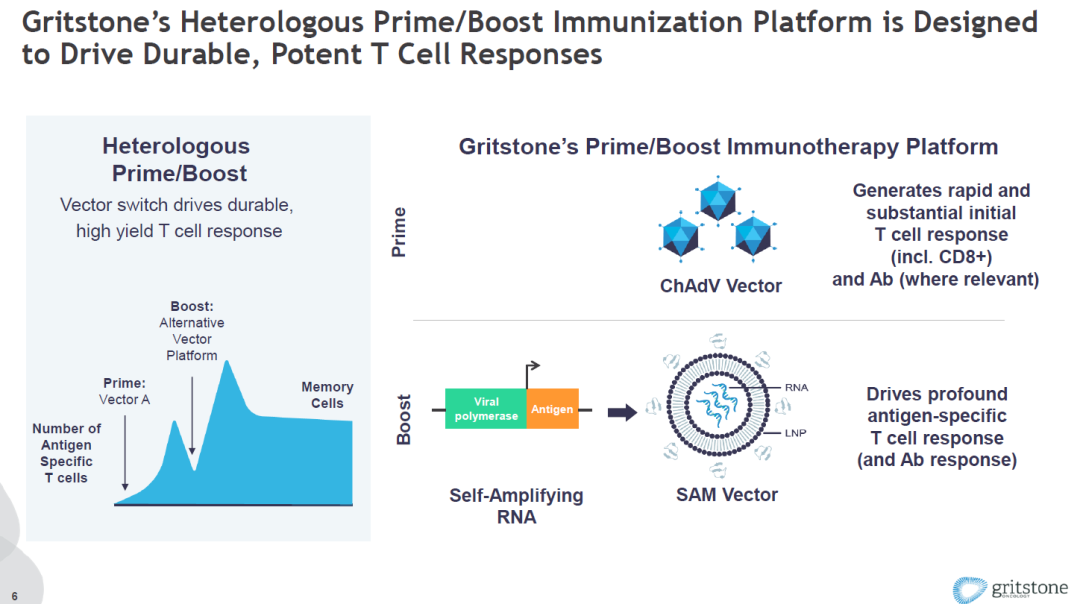
▲Gritstone的独特疫苗平台(图片来源:参考资料[9])
根据协议,吉利德科学将支付6000万美元的前期付款,包括3000万美元的预付款和3000万美元的股权投资。吉利德将负责开展HIV特异性治疗性疫苗的1期临床研究,并在合作下持有独家选择权,获得1期以后开发和商业化HIV特异性治疗性疫苗的独家许可。Gritstone有资格获得高达7.25亿美元的里程碑付款,以及获批产品的销售额分成。




 个人中心
个人中心
 我是园区
我是园区




