NCB封面论文 | 苏士成/江山平团队揭示嗜酸性粒细胞胞外DNA网与神经互作加重哮喘
收藏
关键词:
揭示
资讯来源:BioArt + 订阅账号
发布时间:
2021-10-22

责编 | 兮
当微环境出现大量的胞外DNA时,提示机体发生损伤。粒细胞胞外DNA网
(extracellular traps,
ETs
)
比一般胞外DNA碎片更容易引起机体应激反应。因为其有三个特点:1)DNA呈大张网状结构,很难被细胞吞噬清除;2)DNA成分高度氧化;3)伴有大量致炎的粒细胞颗粒蛋白。有大量研究显示中性粒细胞胞外DNA网
(neutrophil extracellular traps,
NETs
)
在感染、肿瘤、自身免疫疾病等多种重大炎症相关疾病起到重要作用
【1】
。例如,中国科学院上海营养与健康研究所胡国宏团队发现NETs介导肿瘤肺转移
(详见BioArt报道:
【2】
。
既往发现的DNA感受器都在胞内
(内体/胞浆)
。细胞是如何感知ETs这种胞外DNA信号?2020年,中山大学宋尔卫院士和苏士成教授团队Nature研究文章鉴定出一个首个定位在细胞质膜的DNA感受器CCDC25,介导了NETs促进肿瘤转移
(详见BioArt报道:
【3】
。那么CCDC25在其他炎症疾病是否有作用?哮喘影响全球约三亿人口,是最常见的慢性炎症疾病之一。既往报道在病毒或细菌等急性感染诱发的哮喘模型中,NETs起到重要作用
【4,5】
。
2021年10月6日,Nature Cell Biology杂志正式发表了来自中山大学苏士成/江山平团队题为
Eosinophil extracellular traps drive asthma progression through neuro-immune signals
的研究论文。
该研究提出和传统不同的观点:大多数情况下,哮喘肺部胞外DNA网主要来源不是中性粒细胞,而是嗜酸性粒细胞。嗜酸性粒细胞胞外DNA网(eosinophil extracellular traps,EETs)通过CCDC25促进神经内分泌细胞分泌神经肽,加重2型炎症反应。该研究还首次系统地鉴定EETs的蛋白成分,揭示了EETs上的颗粒蛋白EPX放大DNA-CCDC25信号,进一步促进神经肽分泌和2型炎症反应。提示CCDC25和EPX是哮喘治疗新靶点。
应用扫描电镜分析,作者观察到哮喘患者肺泡灌洗液中存在大量胞外网状DNA结构。通过免疫荧光、流式细胞术及ELISA等技术的进一步分析,作者发现,绝大部分胞外DNA网的来源并非传统认为的中性粒细胞,而是嗜酸性粒细胞。
通过在哮喘小鼠中应用多种调控嗜酸性粒细胞细胞因子的中和抗体筛选,该研究发现其中胸腺基质淋巴细胞生成素
(Thymic stromal lymphopoietin,
TSLP
)
中和抗体可以有效遏制肺部EETs形成。TSLP是一种上皮细胞响应刺激物时分泌的细胞因子,近期三期临床试验结果显示,靶向TSLP的人单克隆抗体tezepelumab能够有效控制哮喘患者的病情加重
【6】
。这一成果为TSLP单抗在哮喘中的应用提供了新的作用理论。
肽酰基精氨酸脱亚胺酶4
(peptidylarginine deimnase 4,
PAD4
)
将组蛋白的精氨酸转化为瓜氨酸,促进染色质的松解和胞外网状DNA的产生。作者发现嗜酸性粒细胞高表达PAD4。PAD4基因缺陷的小鼠在过敏原诱导后,肺部嗜酸性粒细胞胞外网状DNA结构明显减少,且肺部炎症水平显著低于野生型小鼠。为了进一步探索嗜酸性粒细胞胞外DNA网在哮喘病程中作用,作者将来自野生型及PAD4敲除小鼠的中性粒细胞和嗜酸性粒细胞输注至PAD4敲除小鼠的气道,结果发现只有野生型嗜酸性粒细胞才能够还原哮喘气道炎症的水平。这一系列结果证明,嗜酸性粒细胞胞外DNA网能够放大肺部炎症,加重哮喘病程。
通过分析在线转录组数据库和免疫荧光,作者发现CCDC25在肺神经内分泌细胞
(pulmonary neuroendocrine cells ,
PNECs
)
细胞表达最高。神经内分泌细胞是在肺部唯一由神经支配的气道上皮细胞,既往研究发现神经内分泌细胞能促进2型炎症反应
【7】
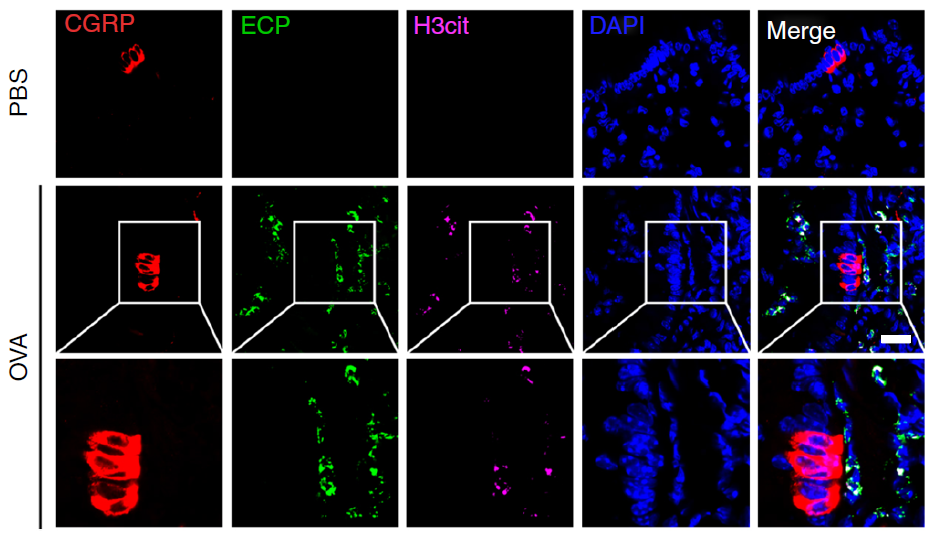
。作者发现,在哮喘小鼠的肺组织中嗜酸性粒细胞胞外DNA网与神经内分泌细胞有密切接触
(图1)
。通过应用高分辨率显微镜对小鼠肺活组织切片进行动态检测,作者观察到嗜酸性粒细胞胞外DNA网能够直接激活肺神经内分泌细胞,使之释放CGRP、GABA等神经肽和神经递质,促进2型炎症炎症因子和粘液分泌。通过阻断CCDC25能明显抑制神经内分泌细胞的激活和哮喘气道炎症反应。为了进一步探索EETs与神经内分泌细胞的关联,作者为PAD4敲除小鼠气道输注了野生型嗜酸性粒细胞,并应用CGRP受体拮抗剂治疗。作者发现,野生型嗜酸性粒细胞的输注提升了PAD4敲除小鼠的哮喘炎症水平,而CGRP受体拮抗剂则能够显著缓解由野生型嗜酸性粒细胞放大的炎症。以上结果说明EETs主要通过神经内分泌细胞上的CCDC25促进哮喘炎症。有趣的是中山大学郭德银教授发现另一个家族成员CCDC50同样调控DNA感受信号,而且该分子也在神经系统高表达
【8,9】
。
图 1 嗜酸性粒细胞胞外DNA网与神经内分泌细胞密切接触
目前中性粒细胞胞外DNA网的结合蛋白构成已经比较明确,但是嗜酸性粒细胞胞外DNA网结合蛋白谱未有报道。作者将嗜酸性粒细胞在体外诱导形成嗜酸性粒细胞胞外DNA网,通过洗涤和DNA酶消化,提取出嗜酸性粒细胞胞外DNA网相关蛋白。应用液相色谱技术,该研究首次描绘了结合于EET-DNA的蛋白谱,发现包括嗜酸性粒细胞颗粒蛋白在内的多种蛋白参与构成嗜酸性粒细胞胞外DNA网。进一步,作者将嗜酸性粒细胞颗粒蛋白与EET-DNA或8-羟基脱氧鸟苷DNA
(8-hydroxy-2’-deoxyguanosine-DNA, 8-OHdG-DNA)
混合后处理具有神经内分泌功能特征的细胞系H146细胞,发现嗜酸性粒细胞颗粒蛋白能够放大两种DNA对H146细胞的激活信号。在此基础上,作者使用五种嗜酸性粒细胞颗粒蛋白分别与8-OHdG-DNA处理H146细胞,发现其中放大作用最显著的是嗜酸性粒细胞过氧化物酶
(eosinophil peroxidase, EPX)
。结合EPX和嗜酸性粒细胞主要碱性蛋白
(major basic protein, MBP)
敲除小鼠哮喘模型,研究证实EPX能够特异放大DNA-CCDC25信号,进一步加剧哮喘炎症。
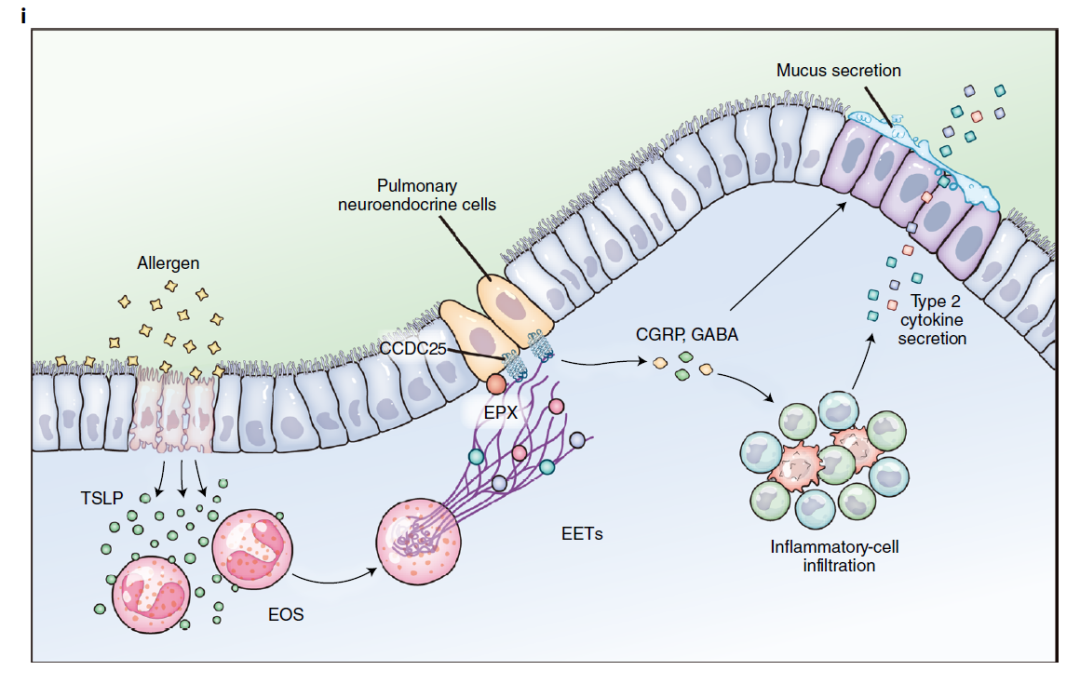
综上所述,
该研究发现了嗜酸性粒细胞胞外DNA网促进神经-免疫系统互作驱动哮喘进展;阐明了嗜酸性粒细胞胞外DNA网在TSLP的调节下形成,通过CCDC25激活肺神经内分泌细胞释放神经肽,从而加剧哮喘二型炎症反应这一机制
(图 2)
。
Nature Cell Biology
杂志同期发表专评,称该研究 “为哮喘治疗提供了新的靶点”
(
In this issue of Nature Cell Biology, Lu et al. provide evidence that eosinophil-derived extracellular DNA traps worsen allergic asthma, presenting a new target for treatment.
)(https://www.nature.com/articles/s41556-021-00765-z)
。该文章被选为当期封面论文
(图3)
。
中山大学孙逸仙纪念医院苏士成和江山平教授为文章的共同通讯作者。陆艺文副研究员、黄一皎、黎江、黄静颖和张丽芝为文章的共同第一作者。宋尔卫院士为本课题的设计给予了宝贵的意见。
https://www.nature.com/articles/s41556-021-00762-2
1. Papayannopoulos V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol 2018;18(2):134-47 doi 10.1038/nri.2017.105.
2. Xiao Y, Cong M, Li J, He D, Wu Q, Tian P, et al. Cathepsin C promotes breast cancer lung metastasis by modulating neutrophil infiltration and neutrophil extracellular trap formation. Cancer Cell 2021;39(3):423-37 e7 doi 10.1016/j.ccell.2020.12.012.
3. Yang L, Liu Q, Zhang X, Liu X, Zhou B, Chen J, et al. DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25. Nature 2020;583(7814):133-8 doi 10.1038/s41586-020-2394-6.
4. C R, C S, C V, C R, P M, F P, et al. Locally instructed CXCR4 neutrophils trigger environment-driven allergic asthma through the release of neutrophil extracellular traps. Nature immunology 2019;20(11):1444-55 doi 10.1038/s41590-019-0496-9.
5. Toussaint M, Jackson DJ, Swieboda D, Guedán A, Tsourouktsoglou T-D, Ching YM, et al. Host DNA released by NETosis promotes rhinovirus-induced type-2 allergic asthma exacerbation. Nature medicine 2017;23(6):681-91 doi 10.1038/nm.4332.
6. Menzies-Gow A, Corren J, Bourdin A, Chupp G, Israel E, Wechsler ME, et al. Tezepelumab in Adults and Adolescents with Severe, Uncontrolled Asthma. N Engl J Med 2021;384(19):1800-9 doi 10.1056/NEJMoa2034975.
7. Sui P, Wiesner DL, Xu J, Zhang Y, Lee J, Van Dyken S, et al. Pulmonary neuroendocrine cells amplify allergic asthma responses. Science (New York, NY) 2018;360(6393) doi 10.1126/science.aan8546.
8. Hou P, Lin Y, Li Z, Lu R, Wang Y, Tian T, et al. Autophagy receptor CCDC50 tunes the STING-mediated interferon response in viral infections and autoimmune diseases. Cell Mol Immunol 2021;18(10):2358-71 doi 10.1038/s41423-021-00758-w.
9. Min JS, Halder D, Yoon JY, Jeon SJ, Jun SY, Lee JR, et al. Coiled-coil domain containing 50-V2 protein positively regulates neurite outgrowth. Sci Rep 2020;10(1):21295 doi 10.1038/s41598-020-78304-3.
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。



 药选址
药选址




