
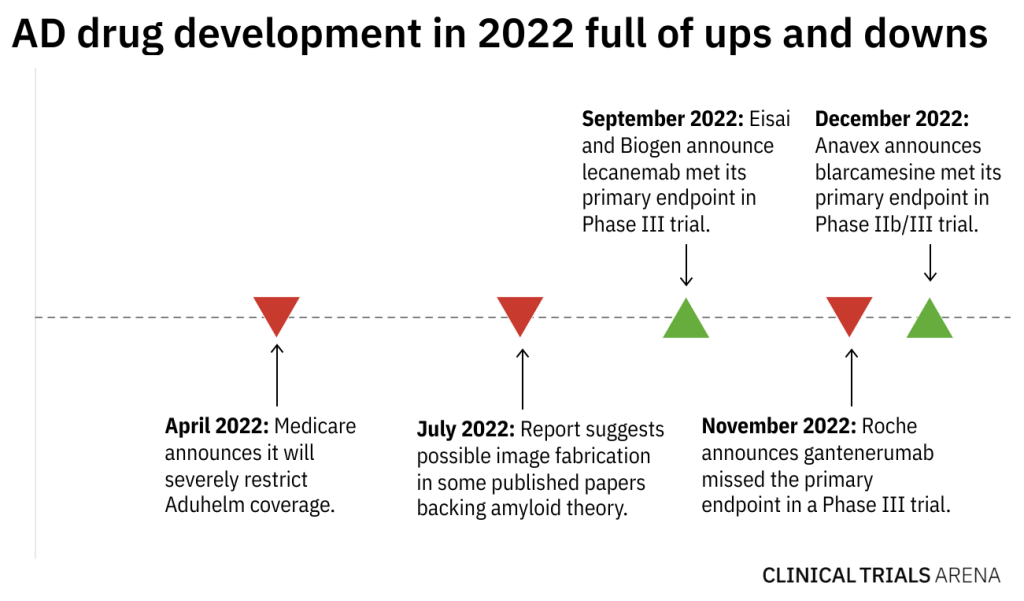
首先是令人兴奋的临床成功。
2022年9月,卫材和渤健宣布lecanemab在一项有1906名患者参加的III期研究(NCT03887455)中,达到减缓认知能力下降速度的主要终点。12月初,Anavex开发的blarcamesine在一项有509名患者参加的IIb/III期试验(NCT03790709)中达到延缓衰退的主要终点。
然而,2022年也充满了坎坷和争议。
11月,罗氏宣布其抗体gantenerumab在III期GRADUATE-1(NCT0344397)和GRADUATE-2(NCT03444870)研究中错过终点。
与此同时,美国Medicare在4月宣布,将严格限制Aduhelm的覆盖范围。这也打破了分析师曾经认为是数十亿美元药物的销售前景。
2022年7月,一份报告显示,支持目前大多数AD疗法背后的淀粉样蛋白(Aβ)理论的研究中,存在着数据操纵。
鉴往知来,下面是可能影响2023年AD药物开发的三个主要问题。

就在四个月前,AD领域还在热切期待着2022年和2023年的四项主要AD药物试验结果。从那时起,所有的目光,似乎都集中在lecanemab和donanemab上。
目前,继Aduhelm的市场失利和gantenerumab的III期试验受挫之后,卫材和渤健的lecanemab顺理成章地成为治疗AD的潜在单克隆抗体。礼来预计,在2023年第二季度,donanemab(NCT04437511)1800名患者参与的TRAILBLAZER-ALZ 2研究将有结果。
问题是,donanemab会不会与lecanemab相匹配或超越?
与渤健合作研究Aduhelm的卫材认为,lecanemab是治疗许多早期阿尔茨海默病患者的一种有效方法,也是一种潜在的重磅产品。2022年阿尔茨海默病临床试验大会(CTAD)上的展示和同期在NEJM上的发表,都是向业界证明这款新药的主要证据。
不过总的来说,lecanemab试验的结果并不突出。临床医生使用18分的临床痴呆评分量表(CDR-SB)来评估大脑和身体功能。在18个月内,跟安慰剂相比,lecanemab治疗的患者CDR-SB下降了0.45分。
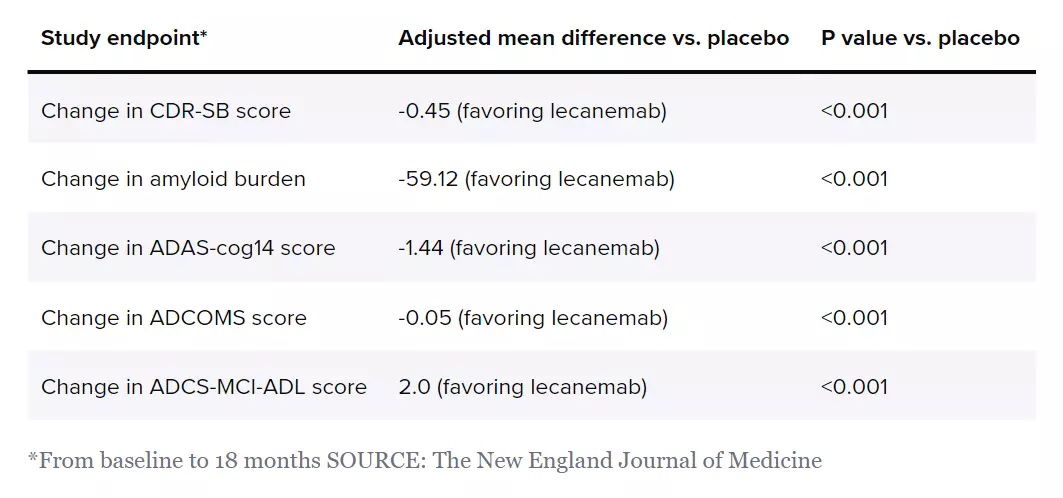
对于一些人,这是一个显著的获益,特别是考虑到该试验允许服用Aricept等其他阿尔茨海默病药物的患者参与。然而,部分AD专家指出,一种药物需要提供至少1-2分的效果,才能被认为具有临床意义。
在NEJM论文中,作者们提出一些谨慎的做法,他们写道:“需要进行更长时间的试验来确定lecanemab对早期阿尔茨海默病的有效性和安全性。”
与lecanemab有力竞争的,现阶段主要是礼来的donanemab。
2022年CTAD,礼来首次披露donanemab与Aducanumab进行“头对头”比较的III期临床 TRAILBLAZER-ALZ 4数据。该项研究共纳148名50-85岁受试者,评估了两款药物对早期AD患者Aβ斑块清除的影响。
结果显示,在这项为期18个月的研究到达第6个月时,37.9%接受donanemab治疗的患者大脑中的Aβ斑块被完全清除,而接受Aduhelm治疗的患者只有1.6%被完全清除率。鉴于Aduhelm已经获批,基于优效结果的donanemab上市似乎是板上钉钉。
然而,TRAILBLAZER-ALZ 4研究的规模,以及采取生物标志物而非症状改善作为终点,这些都令外界有所担忧。
礼来还在推进的更大规模TRAILBLAZER-ALZ 2研究,主要终点为AD综合评定量表(iADRS),它结合了两个有效的终点来测量AD的认知和日常功能。不过,考虑到lecanemab的II期临床数据让一些专家担心,该药的获益可能也是微不足道的。

2022年,多样性和包容性已经成为药物开发领域的共同话题,但AD的试验却明显落后。
在美国,研究表明,黑人老年人患AD或痴呆的可能性比白人老年人高一倍。然而,大多数报告种族的主要AD药物试验,包括Aduhelm和gantenerumab的III期研究,都没有招募大量的黑人患者。
事实上,在gantenerumab的两个III期试验中,只有3%的美国患者是黑人——明显低于美国实际人口的比例。
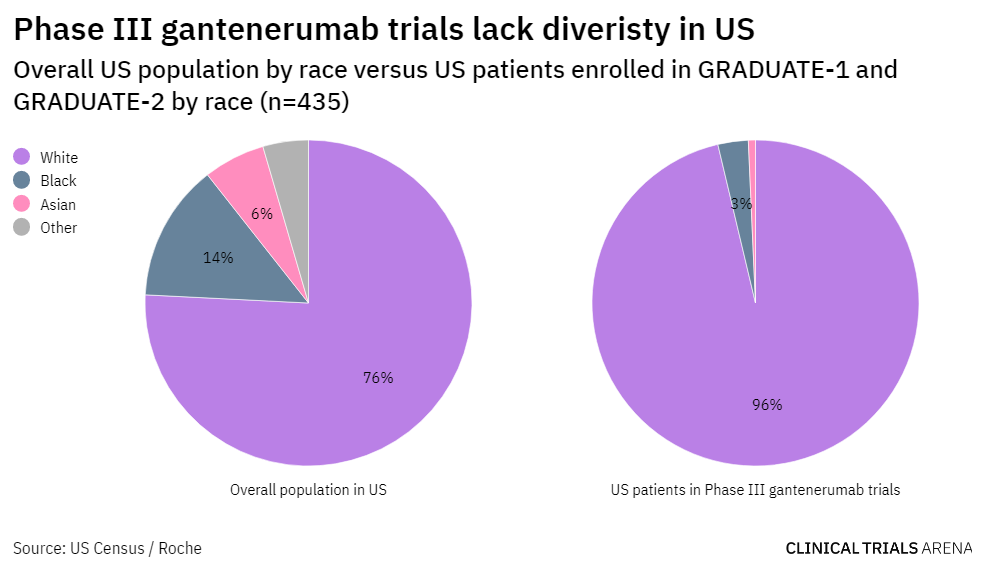
虽然只有罗氏发布了按国家分类的详细人口统计学数据,但其他晚期AD试验中已发布的总体多样性数字也同样令人担忧。
Lecanemab试验的一个显著特征是,约25%的参与者是黑种人或西班牙语裔,这一数字在临床试验中相对较高,而在这些临床试验中,边缘化群体的代表人数严重不足。
试验多样性不仅事关受试者的公平性,还有助于提升药物的有效性。在黑种人和西班牙人群体,他们患糖尿病和心血管疾病的几率更高,而这些疾病都会影响大脑。
随着AD领域进入2023年,预计对临床试验中缺乏多样性的审查会加强。Medicare已经更新了Aβ靶向抗体在AD领域的覆盖标准,包括对参与者多样性的具体要求,以回应日益增长的关注。

Aβ理论认为,减少Aβ斑块在大脑中的积累可以减缓或阻止AD的发展,这一直是最近大多数AD治疗方法的驱动力——包括donanemab、lecanemab、gantenerumab和Aduhelm。由于著名专家的长期支持,大多数AD资金和研究都大量投入到Aβ理论中。
然而,2022年7月Science的一篇文章指出,支持Aβ理论的关键研究可能存在数据操纵,这促使行业进行后续调查。但许多专家认为,积极的lecanemab试验是对Aβ理论的验证,这便引出了一个问题:这种方法将继续主导AD药物的开发吗?
至少罗氏选择离场了。近两个月前,罗氏发布消息称,ganteneruma在III期临床研究失败,因为未能达到具备统计学意义的治疗效果。2022年更早些时候,罗氏的另一款Aβ单抗crenezumab,也在减缓或预防一种罕见的常染色体显性阿尔茨海默病(ADAD)的研究中宣告失败。

根据GlobalData的临床试验数据库,Aβ目前是整个AD管线中最常见的目标,包括临床前候选药物。然而,乙酰胆碱酯酶(ACHE)抑制剂和N-甲基-D-天门冬氨酸受体(NDMAR)拮抗剂等方法也在慢慢壮大起来。
另外,强生已朝着另一个方向发展——tau蛋白在AD患者的大脑中会错误折叠和缠结。该公司与AC Immune合作,推进一种tau疫苗ACI-35.030的开发。在2022年CTAD,AC Immune提交了Ib/IIa期的中期数据,表明ACI-35.030可诱导靶向tau蛋白的抗体产生强烈、持久的诱导。
虽然lecanemab和donanemab的后期结果赚足了风头,但接下来为AD早期临床活动选择的目标,可能会揭示该领域的最终走向。
2018年,美国药物生产与研发协会曾发布了一份AD领域的报告。根据这些数据,2000年到2017年,药企针对AD累计投入的研发费用已超过6000亿美元。但上世纪90年代以来,FDA仅批准6款AD药物上市。更要命的是,这些获批上市的药物,都只能延缓症状发生,疗效有限。
AD赛道的希望在哪?至少近期会有可能令业界更进一步。2023年1月,FDA将对卫材/渤健lecanemab的BLA做出最终决定;而到2月,礼来的donanemab将接受考验。
礼来donanemab在2023年第二季度披露的TRAILBLAZER-ALZ 2研究结果,将决定卫材和渤健lecanemab能否保持其作为可能的AD市场领先抗体的地位。不过客观来说,专家但对这两款药物临床疗效的质疑仍很大。
在促进更具包容性的试验方面,AD领域已经落后于其他适应症。对最近主要的AD试验中缺乏多样性的声讨,可能意味着药企将受到更多的审查,以招募更多的研究。
此外,Aβ的堆积仍然是AD药物管线中最常见的目标。然而,药企在2023年为新的AD疗法选择的目标和新的临床数据,或将显示该领域对Aβ方法的长期信心。






 个人中心
个人中心
 我是园区
我是园区




