
 点击这里,预约最新直播!
点击这里,预约最新直播!
业界要求 FDA 对以患者为中心的药物研发临床结局评价指南提供更加清晰一致的指导
美国 FDA 于今年 6 月份发布了“以患者为中的药物研发:选择、开发或修改适合目的的临床结局评价”指南草案,这是 FDA 承诺发布的以患者为中心的药物研发(PFDD)系列指南文件中的第三篇,系列文件描述利益相关方如何从患者和护理人员那里收集和提交患者体验数据和其它相关信息,以用于医疗产品开发和监管决策。
但几家大型制药企业对于这第三篇指南并不满意,呼吁 FDA 对指南进行修订,以提供更加清晰的指导。具体来说,辉瑞、葛兰素史克(GSK)和杨森都不约而同地各自呼吁 FDA 更明确地说明草案中的一些新概念和术语应如何定义,之前的 PFDD 指南中并没有使用这些新概念和术语,也没有给出定义。
GSK 以患者为中心的结局高级总监Linda Nelsen在反馈意见中写道,“这些新引入的概念并没有足够清晰的定义,为什么建议这些概念用于临床试验结局评价(COA),以及如何将这些概念用于评估COA的适当性,为解释留下了很大空间。”
辉瑞全球监管政策与情报高级总监Richard Jahn补充指出,“在没有更多背景和示例的情况下,对于申办人而言,了解如何有效地将这些新考虑因素纳入其开发计划将非常有挑战,因此,请考虑包括更多背景和示例。”
Genentech 美国监管政策负责人Rasika Kalamegham指出,虽然有些概念很复杂,而且可能使用不止一种类型的COA来评估概念的不同方面,但“我们发现指南在这一点上不一致”,并呼吁进一步明确“不同测量类型配对或组合的策略”,因为随着申办人解决未满足的测量需求,并更全面地了解患者体验,这些策略将变得越来越重要。
再生元监管事务副总裁Edward Cox同样指出,虽然指南草案包括对儿科人群的特殊考虑,但“缺乏对罕见病药物开发中COA的选择、开发、有效性测试和调整的指导。指南包含一节关于罕见病特别注意事项的内容可能会有帮助,尤其是针对超罕见疾病,类似于为儿科人群提供的详细指导。”
勃林格殷格翰(BI)监管事务副总裁 Kathleen Collins 则呼吁 FDA 提出一些更详细的建议,以解决当今肿瘤临床研究中可管理的肿瘤和/或罕见疾病。她补充表示,FDA 应该提醒利益相关者不要试图从头开始研究许多 COA,“在某些时候应承认每种疾病都有组织已经或正在开发 COA 来支持研究和临床试验。”
杨森副总裁 Pauline McNulty 还指出,FDA 应努力让第三份 PFDD 指南草案与第四份指南草案保持一致,第四份指南草案主要内容将是把 COA 纳入监管决策。这两份指南是相互关联的。“我们注意到,如果同时发布第三份和第四份指南草案供征求意见,将会很有帮助。指南 3 是关于方法,而指南 4 是关于为监管决策收集和分析 COA 数据的方法、标准和技术,因此两份指南之间可能存在联系。申办人收集和分析 COA 数据的方式可能会受到开发 COA 方法的影响,反之亦然。应考虑这些潜在联系。”
她还呼吁 FDA 在症状和功能、严重程度评分和能力评分方面添加更多具体示例,以使利益相关者更好地理解 FDA 的具体建议。

聚焦结局评估,FDA第三份以患者为中心的药物开发(PFDD)指南征求意见
识林-白蜡 2022-07-08
6月29日,FDA发布指南草案《以患者为中心的药品研发:选择、开发、或修改适合目的的临床结局评估》,这是以患者为中心的药物开发(PFDD)系列指南文件中的第3篇,描述利益相关方(患者、护理人员、研究人员、医疗产品开发人员和其他人)如何从患者和护理人员那里收集和提交患者体验数据和其他相关信息,以用于医疗产品开发和监管决策。
PFDD是从患者对自身疾病的经验、观点、需求出发,将患者需求纳入药物开发和审评中,以求为患者提供更好的真实世界疗效的系统性方法。

PFDD系列指南主题如下:
指南1 为预期的患者人群收集准确且有代表性的患者体验数据的方法
指南2 确定与疾病/症状和治疗负担相关的对患者产生重要影响的内容的途径
指南3 选择、调整、开发和验证临床试验结局评估(COA)以判别对患者重要的结果的方法
指南4 收集和分析COA数据用于监管决策的措施、标准和技术,包括选择基于COA的终点,并确定该终点变化的临床意义
《21世纪治愈法案》规定,在2017年6月之后提交的新药申请,需要包含用于审评的患者体验数据(Patient Experience Data,PED),具体指从相关群体(患者、患者的家庭成员和照顾者,患者权益组织,疾病研究基金会,研究人员和制药商等)处收集到的可以表征患者对一类疾病/病症体验的信息,包括此类疾病/病症或相关治疗或临床研究的影响以及患者对其疾病或病症治疗的偏好。
指南1 突出信息的代表性
该指南着眼于信息收集时的目标人群和采样策略,概述了构成患者体验数据的内容,并对患者体验数据收集的一般考虑进行阐述,为利益相关方提供了按逻辑顺序排列的一列问题,为多种数据收集提供指导,介绍了涵盖了收集患者体验数据的研究目标的定性和定量方法,以及不同复杂程度的采样方法以及案例。附录中列有数据提交标准和要求。
指南2 侧重信息的重要性
该指南使用了许多示例详细说明了如何确定对患者最重要的关键考虑因素,以及如何进行定性研究,具体包括一对一访谈、焦点小组等定性研究方法、调研管理的定量研究方法以及混合方法以及对一些注意事项的描述。附录中介绍了其他定性方法、选择定性数据收集方法的注意事项,定性研究的学习材料及数据分析,筛选和结束面谈研究。
指南3 着眼于信息的可评估性
并不是所有被患者及相关人员认为重要的事情,最终都能被证明有临床意义,或可用于评估。因此,重要的是,如何选择评估项目以体现临床收益,考虑如何识别或开发适用于药物开发目的的COA,从而评估对患者重要的结局。
该指南提供了COA评估的一般性指导,旨在帮助申办方在医疗产品开发计划中整合高质量的患者健康措施。
指南3的整体结构如下:
临床试验中的COA概述,包括:描述COA的四种类型、COA评估的内容、目的和背景、是否有足够的证据支持其使用;
COA指可以通过临床医生、患者、非临床医生观察员的报告或基于效果的评估来评估临床结局,是描述或反映患者感觉、功能或存活情况的量度。COA评分可用于支持临床试验背景下的疗效、有效性和安全性,以确定医疗产品的临床获益和风险。COA有四种类型:患者报告结局(PRO)、观察者报告结局(ObsRO)、临床医生报告结局(ClinRO)和基于表现的结局(PerfO)。附录A,B,C和D分别包括每种类型的COA的额外考虑因素以及概念框架的说明。选择使用哪种类型的COA是由要测量的需求概念及其应用背景(使用背景)驱动的。临床试验中可以使用多种类型的COA来获取患者体验以及患者疾病或病症的状态。申办者还应告知FDA他们打算如何解释COA中的得分。COA是否符合用途,取决于其作为证据的强度,以支持使用背景下的需求概念(编者注:concept of interest,即患者在疗法中的重点体验,代表着患者的需求,也就是COA必须要关注的内容,暂译“需求概念”以帮助理解本文),当“与医疗产品开发工具相关的验证水平足以支持其使用环境”时,COA被认为是合适的。
申办者和COA开发者在选择、修改或开发COA时可能会考虑的一般过程
可参考临床试验中以患者为中心的结果测量的一般路线图,虽然可能并不适合所有的开发计划。
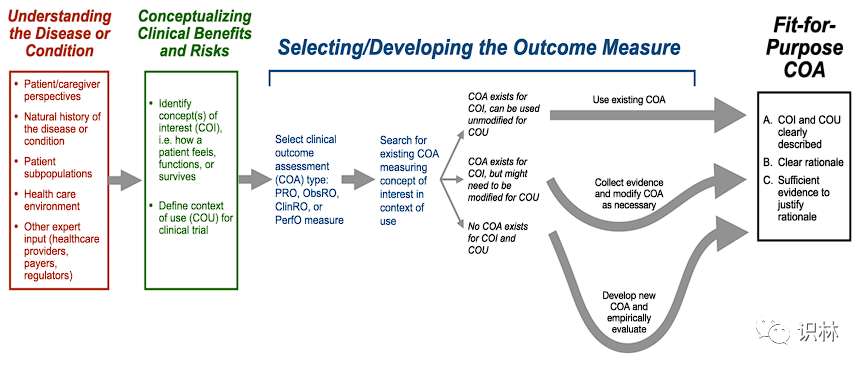
第一步是了解疾病或病症,下一步是临床获益和风险的概念化。概念模型可用于支持路线图的前两部分。之后需要选择或在必要时制定COA来衡量需求概念。路线图描述了申办方为达成合乎目的的COA可采取的建议途径。申办方可以以概念框架的形式构建插图,从而在路线图中展示临床试验中选择COA的每个步骤的结果。概念框架总结了(1)目标人群中患者的相关经历,(2)针对评估的具体需求概念,(3)为每个需求概念拟定的COA类型,以及(4)特定的COA是如何产生反映需求概念的得分的。当存在多个需求概念和COA时,概念框架会特别有用。
FDA建议申办方尽早并在整个医疗产品开发过程中寻求FDA的意见,以确保COA适用于预期的使用环境。
如何构成充分的论证,从而证明COA在特定使用环境下评估需求概念能力
提交给FDA的符合目的的COA的循证理由应考虑八个组成部分:(1)由COA类型来评估需求概念;(2)所选COA指标涵盖了需求概念的所有重要方面;(3)受访者理解措施制定者所预期的指令和项目/任务;(4)COA的得分不会受到不属于需求概念的过程/概念的过度影响;(5)对COA的反馈评分的方法适用于评估需求概念;(6)COA的得分与患者需求概念相关的具体健康经历相对应;(7)评分足够敏感,可以反映患者体内使用背景下需求概念随时间的变化;(8)COA评分的差异可以根据对患者体验的预期影响进行解释和沟通。
指南中还讨论了评估每个组成部分可能的证据来源。不同的试验和使用背景可能需要不同的基本原理和/或证据来支持符合目的的COA。某些类型的研究可能会提供支持多个成分的证据。
目录翻译
指南3
I. 介绍
A. FDA以患者为中心的药物研发指南概述
B. 指南的目的和范围
II. 临床试验中的COA概述
A. COA的类型
B. COA的需求概念和使用背景
C. 确定COA是否符合目的
III. 临床试验中以患者为中心的结局指标的路线图
A. 了解疾病或病症并概念化临床获益和风险
B. 选择/制定结果指标
C. 开发概念框架
IV. 开发证据以支持COA适用于特定使用环境的结论
A. 需求概念应由[COA类型]评估,因为...
B. 所选COA指标涵盖了需求概念的所有重要方面
C. 受访者了解措施制定者所预期的措施说明和项目/任务
D. COA的得分不受不属于需求概念的过程/概念的过度影响
E. COA的响应评分方法适用于评估需求概念
F. COA得分与患者与需求概念相关的具体健康经历相对应
G. COA得分足以反映使用背景下患者体内需求概念随时间发生的有意义的变化
H. COA得分的差异可以根据对患者体验的预期影响进行明确的解释和沟通
V. 缩写
Ⅵ. 选择、修改和开发临床结局评价的有用参考资料
附录A:患者报告的结局指标
I. 介绍
II. 具专业意义的措施的概念性框架示例
附录B:观察员报告的结局指标
I. 介绍
II. ObsRO措施的概念框架示例
附录C:临床医师报告的结局指标
I. 介绍
II. ClinRO措施的概念性框架示例
附录D:表现结局指标
I. 介绍
II. 绩效评估的概念性框架示例
附录 E:COA的理由和支持总结表示例
点击下方卡片,快速绑定/注册识林小程序


推荐阅读

-
辉瑞1.16亿美元收购!|手机APP能检测新冠病毒吗?宇宙第一大药厂斥资1.16亿美元寻找答案 -
诺贝尔化学奖今天揭晓!
-
新药IVPP逻辑 | 一个放之四海而皆准的理论?请投票!~ -
「行业大地震」?「天价猴子」要不香了?美国参议院一致通过「终止动物试验授权」的「FDA现代化法案」 -
干货!恒瑞、百济神州等知名药企2022年上半年「研发支出」、「销售费用」简析 -
【视频】明日开奖!2022诺奖得主即将诞生!您赞同徐亦迅博士的预测吗?|请投票!~
-
上海临床研究中心正式开工!预计2025年底竣工,2026年试运营 -
成功药早,时代要好!药时代敬祝广大朋友们节日快乐!请欣赏优美歌曲和文章!~~
-
健艾仕生物STAT5抑制剂在新冠肺炎引起的炎症因子风暴的临床试验进展顺利 -
卢煜明因无创检测获拉斯克奖,距离诺奖还远吗?
-
卡脖子 or 被卡脖子?生物制药产业供应链「国产替代」,已经需要争分夺秒! -
三款重磅PARP遇挫,FDA再「出手」,NMPA「如何面对」? -
刷新OS数据!H药登上JAMA主刊,PD-1治疗小细胞肺癌重大突破!
-
药企的安得广厦千万间
-
肿瘤药全部扑街!FDA两天开了4场专家咨询委员会,竟然只有一款「粪便疗法」通过了...
-
中国制药江湖「神曲」!~~ 继《PD-1之歌》之后,药时代拟推出《双抗之歌》 | 附:30+篇双抗主题好文章
-
行业再现【淘金者】:我就再赌最后一把! -
三院士齐聚!以临床价值为导向,打造生物医药源头创新机制 | 上海源创新药高峰论坛圆满落幕! -
阿尔茨海默病,可能是我们老去后的结局……
-
RSV领域时隔60年起风云!阿斯利康/赛诺菲,一剂绝尘!
-
罗永庆离开腾盛博药加盟云顶新耀,中国药企挖人大战进入白热化。这是行业成熟的标志吗?请投票!
 点击这里,与几百位朋友们欢聚CMC高峰论坛!
点击这里,与几百位朋友们欢聚CMC高峰论坛!

 点击这里,报名参加第三届中国新药CMC高峰论坛!
点击这里,报名参加第三届中国新药CMC高峰论坛!



 个人中心
个人中心
 我是园区
我是园区





