
目前,首个进入临床的碱基编辑疗法已经开展首次人体临床试验(FIH),后续其他药物的临床试验也即将开展。这些药物主要通过永久改变患者特定位点的单个碱基,可实现沉默、修复、调节和上调基因。
碱基编辑领域领先公司Beam Therapeutics 的首席执行官 John Evans 说:“使用这种工具的方式几乎是无限的。”

来源:Beam Therapeutics公司官网
碱基编辑疗法是在锌指核酸酶、转录激活因子样效应物核酸酶(TALENs)和CRISPR-Cas9等基因编辑疗法临床试验激增的背景下发展起来的。碱基编辑器综合了CRISPR-Cas9的精确性和可修饰基因组的脱氨基酶的技术优势,可将胞嘧啶替换为胸腺嘧啶(C→T)或将腺嘌呤替换为鸟嘌呤(A→G)。
首个进入临床的碱基编辑疗法是Verve Therapeutics与Beam联合开发的VERVE-101,这是一种肝靶向PCSK9沉默碱基编辑器。7月12日,这种药物的杂合子型家族性高胆固醇血症适应症在新西兰开始临床Ib期临床试验。Verve计划招募约40例患者,并将于明年公布中期数据,该公司还打算在今年晚些时候向FDA提交IND申请。

来源:Verve Therapeutics官网
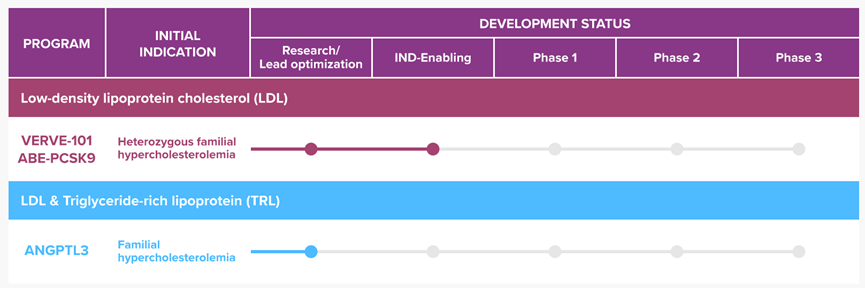
Verve产品管线(来源:Verve Therapeutics官网)
Beam公司的领先产品BEAM-101可促进胎儿血红蛋白生成,可在体外编辑患者来源的造血干细胞(HSC)用于治疗镰状细胞病和 β-地中海贫血。Beam计划在今年晚些时候在美国启动该药物的临床试验。
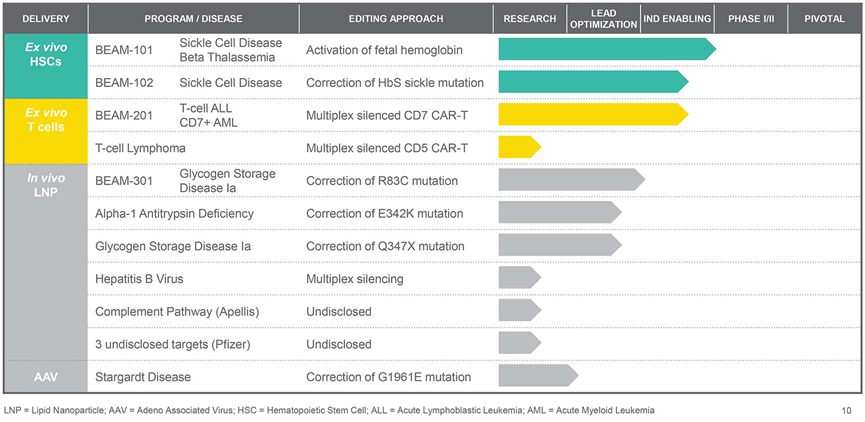
Beam产品管线(来源:Beam Therapeutics官网)
目前,越来越多的公司布局碱基编辑疗法,这表明了这种疗法的巨大潜力,但递送方式仍是研发难点。与其他基因编辑工具一致,肝靶向和体外编辑仍是主要应用方向。Evans表示:“药物递送仍是难题,我们在创新递送方式上的花费的时间几乎与药物一样,甚至更多。”

Beam公司利用电穿孔在体外有效地将药物递送至血细胞和免疫细胞,将LNP 用于体内递送药物至肝脏和其他的其他器官,而 AAV 用于体内递送药物至眼睛和中枢神经系统(来源:Beam Therapeutics官网)

碱基编辑器主要包括3个组分:(1)约20个核苷酸的向导RNA(gRNA),可在靶基因附近结合DNA;(2)修饰的Cas9酶,可解开DNA链;(3)碱基编辑脱氨基酶,可替换靶碱基。细胞的DNA修复机制将缝合缺口,实现与替换的碱基的配对,从而实现完整的碱基编辑。
这种方法是由哈佛研究员、Beam联合创始人David Liu等开创的。2016年,Liu等推出一种结合CRISPR-Cas9的大鼠胞苷脱氨基酶,实现碱基编辑。一年后,他们利用一种与RNA反应的酶设计了一种腺嘌呤碱基编辑器。此后,其他的一些研究团队推出了编辑效率更高、精密度更好的碱基编辑疗法。(推荐阅读:Cell里程碑:碱基编辑「最后一块拼图」,新技术TALED来了)
Liu表示,目前的碱基编辑器只能实现C→T或者A→G的转化,但是作用于DNA两条链间的任意一条碱基链,共可实现4种碱基编辑,有望解决超过60%致病性单碱基突变。与切割方式相比,碱基编辑的安全性更好。包括“标准”Cas9在内的核酸酶都会导致双链DNA断裂,造成靶基因破坏,在修复断裂时可能发生末端错配,DNA发生重大重排,这将导致严重的毒性和致癌性。单个断裂可导致数以百计潜在的基因型,这取决于细胞如何修复双链断裂。Liu表示:“是细胞,而不是我们,决定它们如何修复。”而在碱基编辑过程中,仅一条链被切断,双螺旋结构得以保持,细胞无需考虑如何修复双链DNA断裂。
尽管CRISPR-Cas9的发展更为成熟,碱基编辑技术有望迎头赶上。加州大学伯克利分校研究基因治疗和基因组编辑的教授 David Schaffer 说:“长远来源,这项技术不会造成双链断裂,安全性更好,更有希望。与基因敲除相比,碱基编辑治疗更多疾病的潜力更大。”此外,这种技术还可以在单次编辑中同时操作多个基因。

Verve和Beam领先项目的临床试验将对这种基因编辑策略发挥重要影响。尽管基因编辑赛道非常拥挤,但是碱基编辑疗法仍可以与竞争对手实现差异化竞争。
Verve希望通过碱基编辑解决动脉粥样硬化性心血管疾病患者对降脂药物依从性低的问题。目前的治疗方式包括每天口服他汀类药物以及每2-4周皮下注射一次抗PCSK9抗体。Verve首席执行官Sekar Kathiresan说:“我们的目标是用一种安全有效的疗法实现一次性治疗,显著降低低密度脂蛋白胆固醇。”由于动脉粥样硬化性心血管疾病已有药物获批,新的药物需要具有更高的疗效和安全性标准。Kathiresan认为碱基编辑可以满足上述要求,此前在临床前头对头研究中疗效优于CRISPR-Cas9。
最初由Beam开发的腺嘌呤碱基编辑器VERVE-101在PCSK9的外显子-内含子交界区替换了单个碱基,导致错误剪接和无义介导的mRNA降解。该药物以编码碱基编辑器的mRNA和向导RNA构成,以脂质纳米颗粒(LNP)递送,靶向表达PCSK9的肝脏组织。食蟹猴实验中,单次静脉注射VERVE-101几乎完全抑制了肝脏中的PCSK9,血清中低密度脂蛋白胆固醇水平降低60%,效果持续600天。
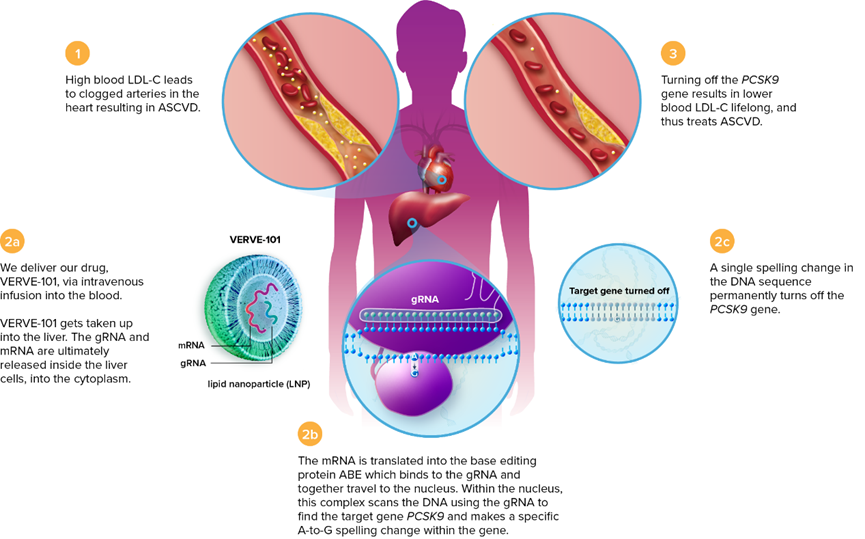
VERVE-101原理(来源:Verve Therapeutics官网)
Verve最初聚焦于杂合子型家族性高胆固醇血症,这是一种导致血清中低密度脂蛋白胆固醇升高的罕见遗传疾病。但是如果碱基编辑器具有良好的安全性,这种疗法还可拓展至心血管主要疾病之一,非家族性动脉粥样硬化性心血管疾病,这会将碱基编辑器的应用范围由罕见病拓展至常见疾病。Kathiresan说,安全性是Verve决定选择碱基编辑最主要的原因。“我们希望最终将碱基编辑应用于影响数百万患者的常见疾病,因此安全性对我们来说非常重要。”
碱基编辑器在心血管领域的机会不只是PCSK9,Verve正在开发沉默另一个已经过验证的降脂肝脏靶点ANGPTL3的基因编辑药物。ANGPTL3特异性抗体evinacumab用于治疗纯合子型家族性高胆固醇血症的适应症已经获批。4月举行的美国心脏病学会年会上,Verve报告称在非人类灵长类动物中连续给药PCSK9和ANGPTL3碱基编辑器对降低血脂具有叠加效应。

Beam则押注β-血红蛋白病。由于对HSC进行离体编辑后重新输回患者可以避免递送困难和脱靶编辑风险,这已经成为基因靶向疗法的首选方案。其他基因编辑公司已经为开发作用于抑制胎儿血红蛋白表达的转录因子BCL11A的碱基编辑器奠定了基础。BCL11A沉默突变将导致一种叫做遗传性持续性胎儿血红蛋白综合征的良性症状,可预防镰状细胞病和β-地中海贫血。Sangamo、CRISPR Therapeutics 和 Intellia 使用各自的编辑器切割 BCL11A 并激活胎儿血红蛋白基因。BEAM-101旨在采取更直接的方法,通过胎儿血红蛋白基因启动子中的碱基交换,构建了一种可导致胎儿血红蛋白遗传持久性的自然变异。Beam另一正处于IND-enabling研究阶段的项目则更进一步,希望通过纠正单点突变将镰状血红蛋白恢复至正常形态。
与其他基因疗法一样,碱基编辑器也有免疫原性的风险。相对于以CRISPR直接删除基因,以碱基编辑基因产生正常的基因带来的血红蛋白及肌红蛋白中与铁卟啉基相结合的蛋白质(globin)可能激活免疫系统。但是Evans表示,目前的基因疗法临床试验中引入的新蛋白质一般不会引发免疫反应。
Beam也在利用碱基编辑器对抗肿瘤细胞同时进行多个编辑,开发自己的细胞疗法。Evans表示,CRISPR-Cas9最多同时删除3个基因片段,但这将对细胞活性造成重大干扰,而碱基编辑则不会。Evans表示:“你可以放入碱基编辑器和你期望的任意数量的向导RNA,同时对多个位点进行编辑。细胞没有问题。”
BEAM-201即将进入临床试验,该公司对CAR-T细胞的TRAC、CD52、PD1和CD7进行碱基编辑,可实现同种异型应用,减轻患者对这些细胞的排斥,提高CAR-T细胞的疗效和寿命。同时,每次碱基编辑过程效率在96%-99%间。这种靶向CD7的CAR-T细胞可以在体内特异性攻击肿瘤细胞。

尽管碱基编辑不会导致染色体重排,脱靶碱基编辑仍是FIH中最为关键的问题之一。尽管向导RNA通过20个核苷酸序列识别靶基因,但如果其他地方有相似的序列,向导RNA将导致错误的碱基编辑。由于碱基编辑器在大约5个碱基对窗口中作用,如果同源碱基在该窗口中多次出现,则会导致“旁观者编辑”。尽管这些事件可以预测和筛选,但是对事件发生后的后果的解释仍较为困难。Schaffer说:“我们可以做大量的测序工作,了解脱靶突变的性质。但至于这种突变对患者具有怎样的风险,这就难说了。”
更令人担忧的是,与CRISPR-Cas9相比,碱基编辑器将导致更多的随机脱靶编辑。Miccio表示:“如果没有向导RNA,CRISPR-Cas9本身不会接触DNA。但无论向导RNA存在与否,碱基编辑器都会作用于DNA,这是你无法预料的事情。”此外,碱基编辑器还可独立于向导RNA编辑RNA。Miccio说:“你可以在临床前研究中做尽可能多的事情,但最终还是要通过患者临床试验给出答案。”
研究人员正在抓紧解决这一问题。Liu研究团队设计了一组胞嘧啶碱基编辑器,与向导RNA无关的脱靶DNA编辑减少10-100倍;另一个研究小组利用诱变来控制3个碱基编辑器实现RNA编辑。
新的递送系统也可以限制脱靶效应。第一代碱基编辑器是通过递送mRNA后在靶细胞中转录得到的,这种方法可以充分利用LNP的递送优势。但是只要mRNA存在,这些碱基编辑器就会一直表达。因此,直接递送半衰期更短的碱基编辑器具有额外的优势。但是递送这种分子量较大的蛋白质需要新的递送策略。Liu等在小鼠模型中证实,装载有蛋白形式碱基编辑器的工程化无DNA病毒样颗粒可以对小鼠体内的肝脏和眼进行基因编辑,这种蛋白质在体内不会四处游荡,因此研究人员并未检测到显著的脱靶编辑。

利用碱基编辑器作用其他组织需要更多创新,但目前已有苗头出现。
Beam筛选了多种LNP处方,用于提高各类细胞的摄取。公司于5月在美国基因与细胞治疗学会上报告说,已经可以在体内实现将mRNA递送至T细胞和NK细胞,有望直接在患者体内编辑免疫细胞。此外,该公司还与Pfizer合作开发可进入中枢神经系统和肌肉的碱基编辑器。
学术界也在发力。来自华盛顿大学的Andre Lieber等人在小鼠体内实现了胎儿血红蛋白的体内碱基编辑。他们利用一种靶向HSC的腺病毒载体将碱基编辑器递送到从骨髓迁移到循环系统中的HSC。这项工作还需要进一步的研究以完善递送系统,但一旦实现临床转化,可以避免对HSC进行离体编辑再回输到体内的过程。
CRISPR和寡核苷酸等技术的进展有望将各类药物递送至更多的细胞类型。首批碱基编辑器是利用CRISPR-Cas9来实现精确靶向的,但是研究人员并不热衷于这种方法。例如,一些研究团队将碱基编辑器和转录激活因子样效应物(TALE)蛋白用于结合特定的DNA序列。另一研究团队最近表明,全蛋白碱基编辑器对于解决线粒体突变特别有用。
一些公司还在研究针对RNA的碱基编辑器以实现在转录水平上的瞬时作用。对于这种方法,它们可以将可实现A→G替换的内源性RNA脱氨基酶重新靶向至目标碱基。Wave Life Sciences 的首席执行官 Paul Bolno 说:“我们将向导链递送到细胞中,接下来的事情水到渠成。”对于Bolno而言,RNA编辑的非永久性可以更方便的控制剂量,降低了脱靶编辑的可能性。“能否通过DNA编辑实现这一点是一个问号。”但是,使用RNA碱基编辑器重复给药将带来经济问题与患者依从性问题,同时还面临着免疫原性问题。

总结而言,不管是靶向DNA还是RNA,碱基编辑不是解决所有遗传性疾病的万能钥匙。由基因缺失、基因重复扩充和其他复杂缺陷导致的疾病则需要通过其他基因靶向工具(如基因疗法、RNA干扰和反义寡核苷酸)等技术治疗。目前也已经出现了新的技术,如由Liu的实验室开发的引导编辑(prime editing)。这种方法具有更改任意碱基,甚至重写DNA片段的潜力,不依赖于脱氨基酶对碱基进行化学修饰,而是通过使用引导编辑向导RNA的逆转录酶改写靶DNA。目前,Liu创办的Prime Medicine正与Beam合作推进这种疗法。
与此同时,Feng Zhang 实验室的研究人员研究了细菌中CRISPR-Cas9 的起源。他们打开了具有多种机制的RNA引导核酸酶的宝库,为潜在的治疗方法提供了新途径。
Liu表示:“我为整个领域欢呼,这对正在遭受DNA突变的数以亿计的人非常关键。”




 个人中心
个人中心
 我是园区
我是园区




