

来源:CDE官网
LM-108申报信息
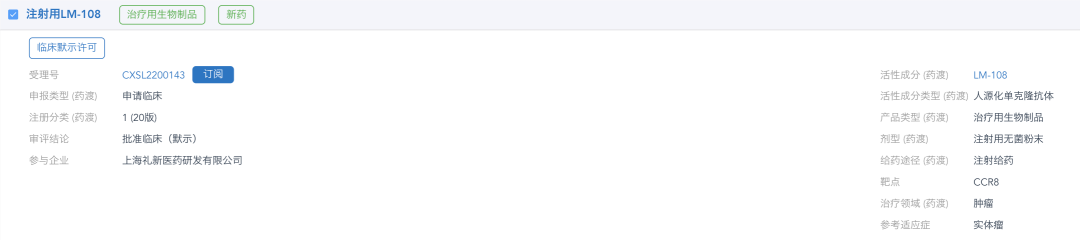 来源:药渡数据库
来源:药渡数据库
LM-108有望为晚期肿瘤患者带来新的免疫治疗选择,同时也能使部分对现有免疫疗法耐药或不适用的患者获益。
LM-108研发状态
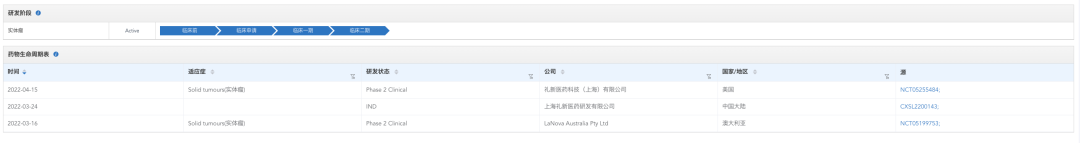
来源:药渡数据库
目前正在进行的两项临床试验,一项为今年3月16日开始的临床II期试验,针对晚期实体瘤,用于评估LM-108作为单药或与抗PD-1抗体联合使用的安全性、耐受性、药代动力学和初步疗效(NCT05199753)。计划招募60人,于澳大利亚展开,预计将在2024年6月完成试验。
另外一项为今年4月15日,在美国开展的一项II期临床试验,同样也是针对晚期实体瘤,评估LM-108作为单药或与Pembrolizumab联合治疗晚期实体瘤的安全性、耐受性、药代动力学和初步疗效(NCT05255484)。计划招募54人,预计将在2024年9月14日完成试验。
海外临床进展
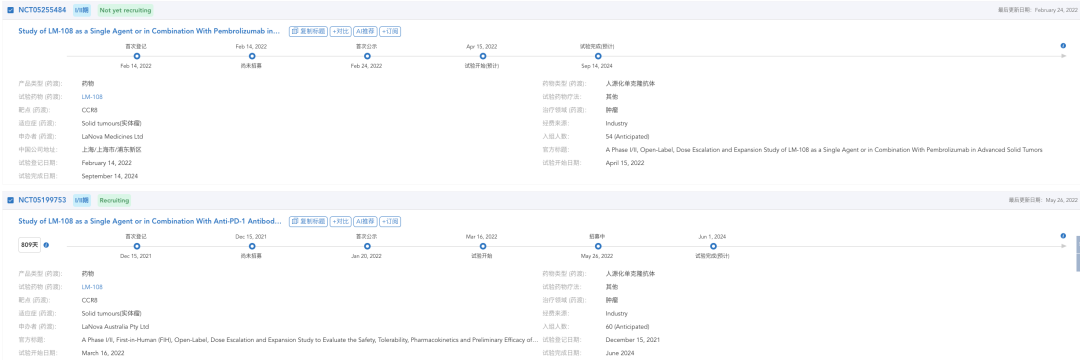
来源:药渡数据库
礼新医药专注于以GPCR及多次跨膜蛋白为靶点的单抗类大分子抗肿瘤药物的研发,目前已经成功将抗体偶联药物(ADC)、单抗、小分子药物推向全球领先的临床阶段。
礼新医药管线

来源:礼新医药官网
根据药渡数据库调研,礼新医药布局集中在实体瘤和血癌两个领域。其中进展较快的的有LM-061、LM-102、LM-302和LM-108,其余多款产品处于临床早期阶段。
LM-061是一种c-Met/HGFR抑制剂,VEGFR2抑制剂和FLT3抑制剂,目前已进入临床II期,评估在晚期肿瘤受试者中该药物的安全性、耐受性、药代动力学和初步疗效,于2021年5月开始试验,预期将在2024年的8月结束。
LM-102靶向Claudin 18.2的单抗,2021年6月,在美开展临床I期试验,用于实体瘤治疗;国内正在进行一项评价LM-102注射液单药或联合治疗在CLDN18.2阳性的晚期实体瘤患者中的安全性、耐受性、药代动力学、免疫原性和抗肿瘤活性的开放、多中心的I/II期临床研究。
值得注意的是能够靶向Claudin18.2的ADC药物LM-302的进展。
在2022年5月5日,礼新医药与美国Turning Point公司达成一项独家授权协议:Turning Point将作为独家合作伙伴,获得LM-302在全球除大中华区及韩国以外国家及地区的开发及商业化权益。此外,此次合作还授予了双方未来扩展潜在合作的权利。
根据协议,Turning Point将支付礼新医药2500万美元的首付款,研发里程碑1.95亿美元及后续商业化里程碑,总金额超过10亿美元。礼新医药还有权从Turning Point区域年净销售额中获得高达两位数百分比的梯度特许权使用费。此外,双方还可共同开发3个后续ADC产品,进一步拓展合作范围。
LM-302通过海外授权获得的巨额资金将驱动礼新医药未来的研发更进一步,不光是LM-108,更有其他项目持续推进。
参考资料
礼新医药官网
药渡数据库




 个人中心
个人中心
 我是园区
我是园区




