2022 年即将结束。在 2023 年前夕,我们一同来展望明年将有哪些重磅 III 期临床结果即将出炉,又将带来怎样的突破?
注:本文排名不分先后,里程碑来自企业官方资料或 ClinicalTrials.gov 官网,时间可能存在波动。
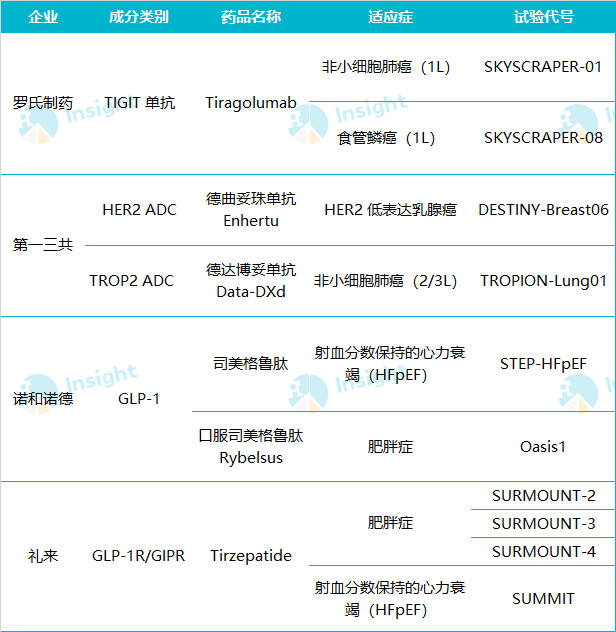
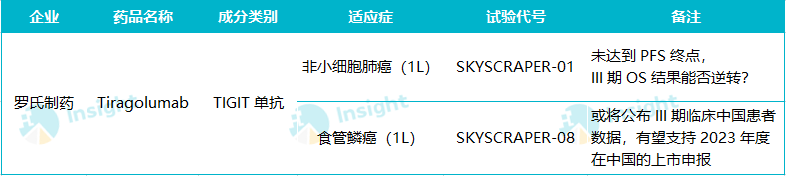
作为首个 TIGIT 单抗,Tiragolumab 的一举一动备受关注。今年其小细胞肺癌和非小细胞肺癌两项 III 期临床先后宣布未达到 PFS 主要终点,这无疑为 TIGIT 靶点的研发泼上了一盆冷水。不过故事并未结束,因为针对 NSCLC 的 SKYSCRAPER-01 研究还在继续进行,等待 OS 数据的证明。
SKYSCRAPER-01 是针对初治 PD-L1 高表达局部晚期、不可切除或转移性 NSCLC 的随机、双盲、全球多中心 III 期临床,考察 Tiragolumab 联用 PD-L1 单抗阿替利珠单抗
(Tecentriq®)
的疗效和安全性。据罗氏近期临床里程碑的披露,2023H1 或将公布 SKYSCRAPER-01 试验结果,届时 OS 结果有望出炉。罗氏表示,在中期分析中就已经观察到了共同主要重点 PFS 和 OS 在数值上的改善。
Tiragolumab
截图来自:罗氏 2022 研发日
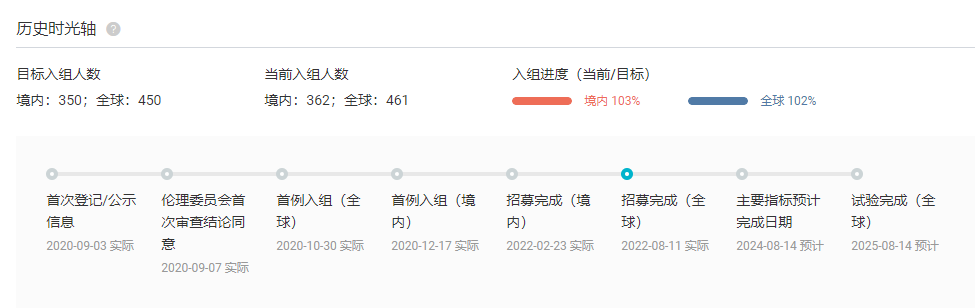
此外值得关注的 III 期临床结果还包括 SKYSCRAPER-08 研究。这项临床在中国境内入组了 362 例患者,据罗氏 Q3 季报,首项上市申请也将发生在中国。
SKYSCRAPER-08 试验时光轴
截图来自:Insight 数据库(http://db.dxy.cn/v5/home/)
HER2 低表达乳腺癌继续拓展,TROP2 ADC 首个 III 期结果将出炉
第一三共在 ADC 领域十分强势。今年凭借 Enhertu 在 HER2 低表达乳腺癌的突破性研究 DESTINY-Breast04
(以下简称 DB04)
,引领了乳腺癌诊疗标准上的革新,点燃这一赛道;随后又拿下了首个 NSCLC 适应症监管批准。在中国,Enhertu 也已经开启了上市之路。
而凭借在乳腺癌乃至其他 HER2 表达癌种的全方位布局,之后重要临床结果也有望持续释放。
DESTINY-Breast06
(简称 DB06)
是针对 HR 阳性 HER2 低表达乳腺癌的一项 III 期临床,纳入的患者群体为内分泌治疗后进展、未接受过化疗
(post ET,chemo-naive)
的转移性乳腺癌患者。与此区别的是,DB04 针对的是既往经历过内分泌治疗和一至二线化疗的不限 HR 状态的患者。在 DB06 上若取得积极结果,意味着在 HER2 低表达乳腺癌中的治疗线数前移。
截图来自:第一三共 2022 研发日
TROP2 ADC 德达博妥单抗
(Dato-DXd)
在 NSCLC 领域即将拿到的 III 期临床结果也值得期待,这将是全球第 2 款 TROP2 ADC 的首个 III 期临床结果。如果拿到积极结果,或许这款 ADC 也离上市申报不远了。
值得一提的是,身处 ADC 领域竞争第 2 激烈的 TROP-2 赛道,德达博妥单抗在适应症上差异化布局,不和其他产品强卷三阴乳腺癌
(但并未放弃 TNBC)
,而首要攻占 NSCLC。NSCLC 也将成为德达博妥单抗的首发适应症。
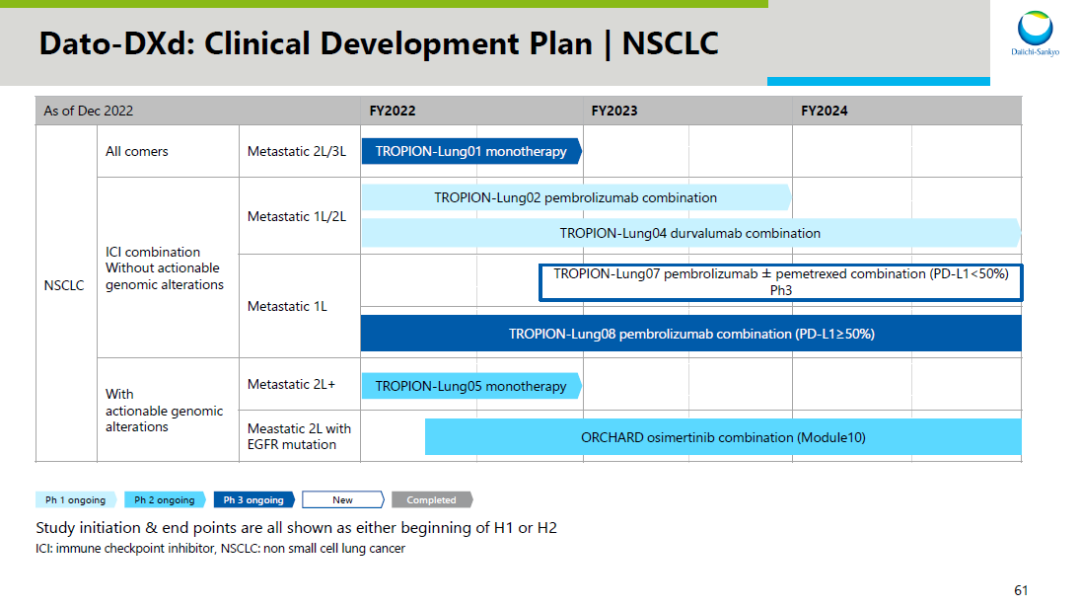 截图来自:第一三共 2022 研发日
截图来自:第一三共 2022 研发日
多提一句,第一三共 ADC 领域在 2023 年的预期里程碑还不止于此。HER3 ADC 药物 Patritumab deruxtecan
(U3-1402)
用于后线 EGFR 阳性 NSCLC 的注册 2 期临床 HERTHENA-Lung01 研究也有望在 2023 年释放关键数据,此前已公布数据显示,U3-1402 对 EGFR-TKI 耐药的 NSCLC 给出了相当亮眼的数据。
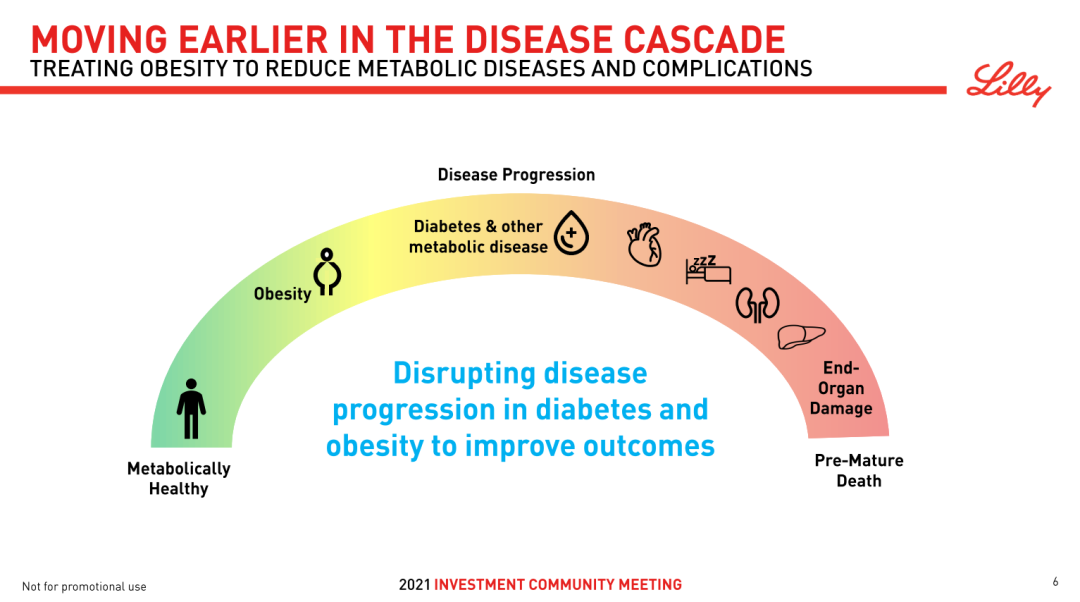
引用礼来在 2021 投资者日中的 PPT,糖尿病和肥胖症是多种代谢疾病的潜在因素,因而在代谢领域进行布局的企业往往可考虑串联多种相关疾病做全面的布局,不断增强加厚产品的覆盖范围和竞争力。
截图来自:礼来 2021 投资者日
司美格鲁肽是 GLP-1 赛道上的明星药,2021 年度全球销售额
(不计口服)
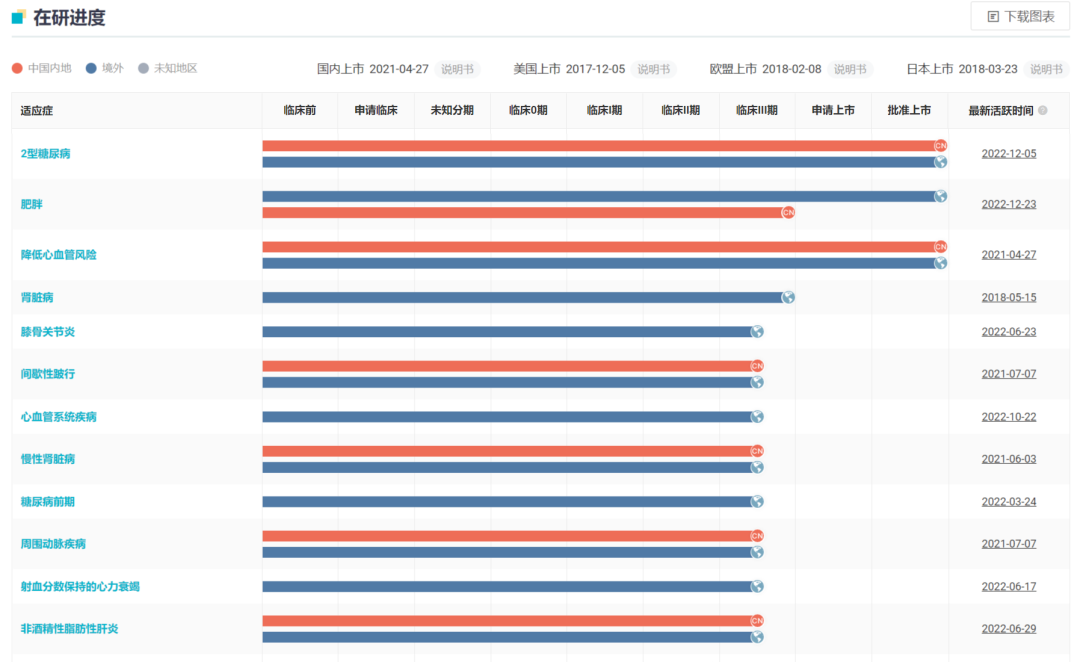
已达到 53.46 亿美元。在 2 型糖尿病和肥胖症的成功之上,诺和诺德也在不断布局其他代谢领域疾病,以将其适应症范围拓展,HFpEF 有望成为 NASH 之后第 4 个公布临床结果的适应症。
司美格鲁肽全球适应症进度
截图来自:Insight 数据库
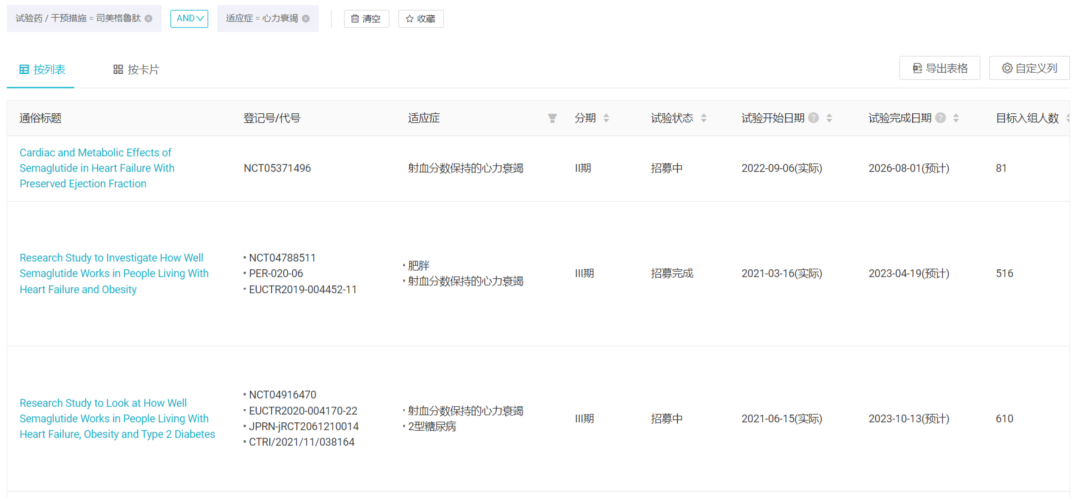
心力衰竭为各种心脏疾病的严重表现和终末阶段,由此所引发的再住院率高达 24.5%,确诊后死亡率几乎可以比肩常见的恶性肿瘤,是最危险的心血管疾病之一。随着老龄化程度的不断加深,大量高血压、冠心病、糖尿病患者使心衰「后备军」队伍庞大。据 Insight 数据库显示,司美格鲁肽登记了 3 项 HFpEF 临床试验。
司美格鲁肽已登记 HFpEF 临床试验
截图来自:Insight 数据库
而对于不需住院的慢性疾病而言,口服药物的依从性优势将更加凸显。诺和诺德开发的口服司美格鲁肽 Rybelsus 目前仅获批用于 2 型糖尿病,而这款药物针对肥胖症的 Oasis1 III 期临床试验预计主要指标完成日期在 2023 年 3 月,有望在明年释放结果,并冲击上市。
如若成功,Rybelsus 作为口服减重药物,相较于同领域的注射剂们优势可谓十分可观。能否以夺目姿态强势杀出?
Oasis1 试验时光轴
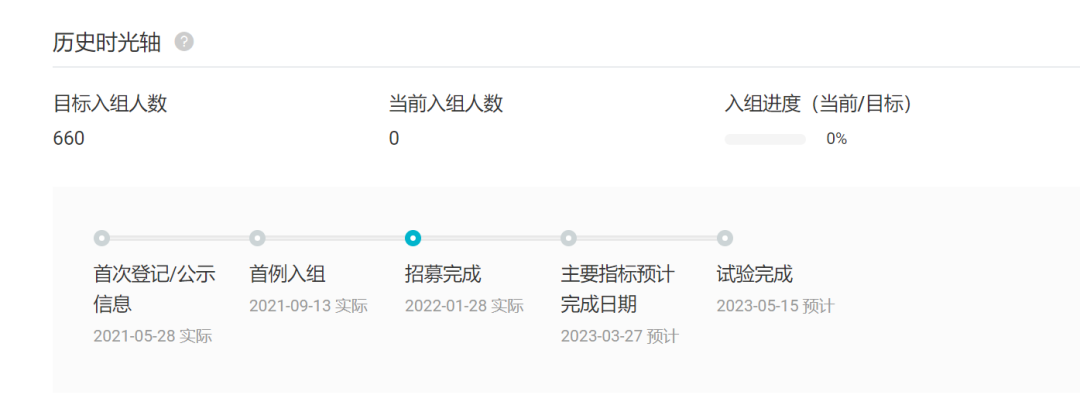
截图来自:Insight 数据库
礼来的 Tirzepatide 去年很是火了一把,凭借着 SURPASS 系列 III 期临床、尤其是头对头明星药司美格鲁肽取得的成功,带着降糖药们卷上了新高度。
Tirzepatide 在减重领域主要布局了 6 项 III 期临床,包括 SURMOUNT-1~4 以及在中国和日本开展的 SURMOUNT-CN 和 SURMOUNT-J。除此之外还包括针对肥胖相关并发症的 SURMOUNT-OSA 和 SURMOUNT-MMO。
今年 9 月,礼来已经公布了 SURMOUNT-1 的临床数据,研究周期为 72 周,包括 20 周的剂量递增期结果显示,与安慰剂
(2.4%,2 kg)
相比,Tirzepatide 受试者平均体重降低了 16.0%
(5 mg 组, 16 kg)
、21.4%
(10 mg 组, 22 kg)
和 22.5%
(15 mg 组, 24 kg)
。
据礼来披露的 2023 潜在里程碑,Tirzepatide 的 SURMOUNT-2、3、4 这 3 项临床即将释出结果。四项结果集结,肥胖适应症上市在即。
礼来 2023 年度潜在里程碑

截图来自:礼来 2023 Guidance Call
不仅 Tirzepatide,礼来的 Aβ 单抗 Donanemab 也将在 2023 年度释放 III 期临床结果。Donanemab 已经通过加速通道向 FDA 递交上市申请,2023 年初就将迎来审评结论,而同年将公布的 III 期临床结果,则是这一加速上市申请的验证性研究,将作为支持其正式批准的重要证据。



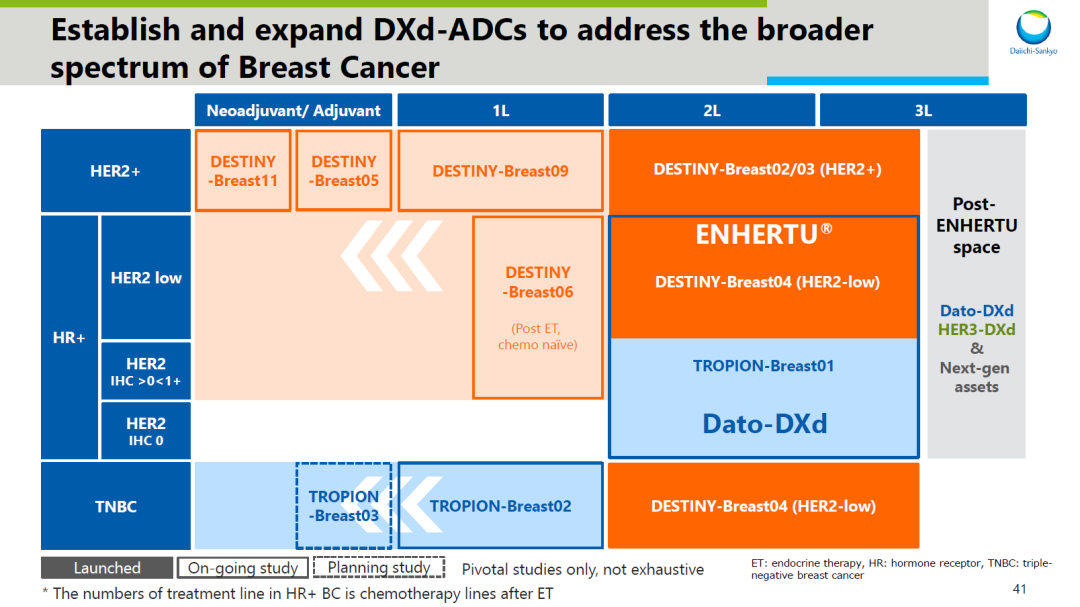
 截图来自:第一三共 2022 研发日
截图来自:第一三共 2022 研发日









 个人中心
个人中心
 我是园区
我是园区




