▎药明康德内容团队报道
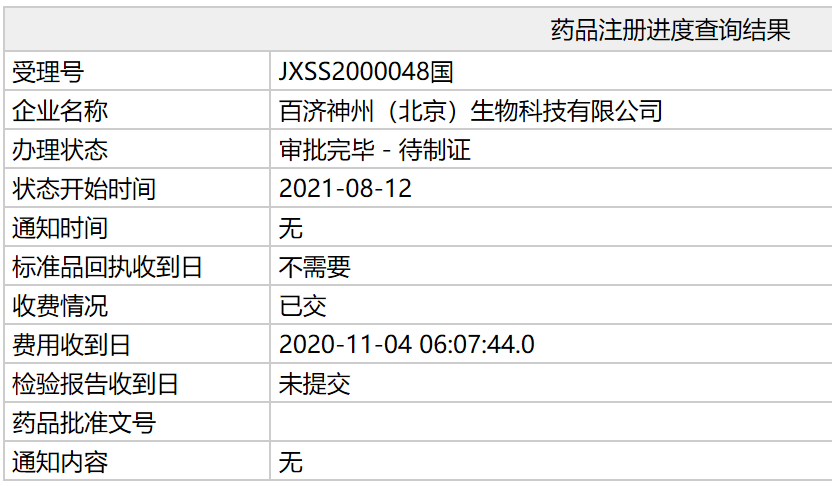
近日,中国国家药监局(NMPA)公示,百济神州引进的达妥昔单抗β(又称:迪妥昔单抗)上市申请办理状态已更新为:审批完毕-待制证。如果正式获批,该药将惠及中国多种神经母细胞瘤患者。
公开信息显示,达妥昔单抗β是百济神州从EUSA Pharma引进的GD2靶向单克隆抗体Qarziba(dinutuximab beta),曾被NMPA药品审评中心(CDE)纳入
。
神经母细胞瘤是婴幼儿中最常见的癌症之一。它是一种极具侵袭性的肿瘤,具有高危神经母细胞瘤的儿童通常经历许多轮复杂而密集的治疗,包括化疗、手术、干细胞移植、放疗等。然而,数据显示,即使采用高度强效的治疗,患者的生存率仍低于50%。因为恶性程度高,治疗难度大,它被称为“儿童肿瘤之王”。
公开资料显示,达妥昔单抗β可以与神经母细胞瘤细胞过度表达的特定靶标GD2结合。它可以诱导双重免疫机制,使免疫系统破坏神经母细胞瘤的癌细胞。2017年,
达妥昔单抗β已获得欧盟委员会批准,
用于治疗≥12 月龄的高危神经母细胞瘤患者,这些患者既往接受过诱
导化疗且至少获得部分缓解,并且随后进行过清髓性治疗和干细胞移植治疗;
也适用于治疗伴或不伴有残
留病灶的复发性或难治性神经母细胞瘤。
根据百济神州早前发布的新闻稿,
达妥昔单抗β是欧洲药品管理局(EMA)唯一批准的用于治疗高危神经母细胞瘤的靶向肿瘤免疫疗法。
2020年1月,EUSA Pharma与百济神州签署协议,前者授权百济神州在中国大陆独家开发和商业化达妥昔单抗β的权利。2020年11月,百济神州与EUSA Pharma等公司共同在中国递交了达妥昔单抗β的上市申请。
值得一提的是,
该产品
还被CDE纳入优先审评
,拟定适应症详见下图
。
根据一项名为APN311-302的关键3期临床研究,在高危神经母细胞瘤一线治疗的维持阶段使用达妥昔单抗β,事后分析显示,与未使用免疫疗法的患者(n=450)相比,接受达妥昔单抗β治疗的患者(n=367)生存期得到了改善,三年总生存(OS)率提高了12%,五年时OS率约为65%(vs 50%)。
研究还显示,未接受过免疫治疗的患者在治疗维持期中使用
达妥昔单抗β
,也可用于防止某些高危神经母细胞瘤患儿复发或进展。
据EUSA Pharma早前发布的新闻稿,通过利用人体自身的免疫系统,达妥昔单抗β已显示出可以非常有效地靶向和攻击某些癌症。对于某些孩子而言,这可能意味着与家人在一起的时间增加数周或数月,而对于另一些孩子来说,这甚至可能让他们长期无癌生存。
因此,该产品获得了英国国
家健康与护理卓越研究所(NICE)推荐,用于治疗儿童高危神经母细胞瘤。
如果百济神州引进的达妥昔单抗β在中国正式获批,该药将
惠及更多
中国儿童高危神经母细胞瘤患者。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1]药品注册进度查询
. Retrieved Aug 16,2021, from http://sq.nmpa.gov.cn/datasearch_nmpa/schedule/search.jsp?tableId=43&tableName=TABLE43&columnName=COLUMN464,COLUMN475&title=%D2%A9%C6%B7%D7%A2%B2%E1%BD%F8%B6%C8%B2%E9%D1%AF
[2]EUSA Pharma与百济神州签署SYLVANT®及QARZIBA®▼在大中华地区的独家开发和商业化协议. Retrieved Jan 13,2020, from
https://www.prnasia.com/story/270326-1.shtml
[3]EUSA Pharma: NICE Approves the Targeted Cancer Immunotherapy, QARZIBA® (dinutuximab beta) to Treat Children with High-Risk Neuroblastoma. Retrieved Jul 11,2018, from https://www.businesswire.com/news/home/20180711005665/en/
声明:本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转发/复制至其他平台。转发授权请在「医药观澜」微信公众号留言联系我们。





 药选址
药选址


