
生物体的能量储存对其应对多变的环境至关重要。在细胞中,能量主要以中性脂质的形式储存在脂滴 (LD) 中【1】。脂滴在进化上高度保守,在哺乳动物中已经进化出专门储存能量的脂肪细胞和脂肪组织【2, 3】。了解脂滴形成/生长和脂肪生成的基本机制有助于我们今后治疗肥胖及其相关代谢疾病。
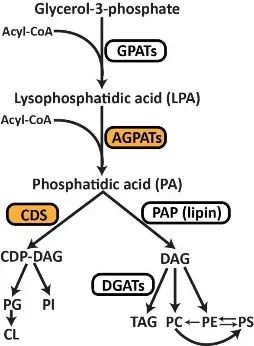
AGPATs/LPAATs是一类由3磷酸甘油合成鳞脂 (PA) 和甘油三酯 (TAGs) 的关键中间酶【4, 5】。在这个途径中,3磷酸甘油首先被酰基转移酶(GPAT)催化形成1-酰基甘油-3-磷酸(LPA),随后LPA的sn-2位点被AGPATs酰化形成PA。PA是一个关键的脂质中间体,它可以被PA磷酸酶(PAPs,例如lipins)去磷酸化形成甘油二酯(DAGs),也可以通过CDP-DAG合成酶1和2(CDS1和2)转变成CDP-DAG【6】。AGPATs有五种亚型,其中AGPAT2尤为突出,其功能失活突变会导致先天性全身性脂肪代谢障碍 1 型(BSCL1/CGI1),早发表现为胰岛素抵抗,糖尿病,高血脂和脂肪肝【5, 7】。
近日,新南威尔士大学杨洪远教授课题组在Nature Communications在线发表了题为AGPAT2 interaction with CDP-diacylglycerol synthases promotes the flux of fatty acids through the CDP-diacylglycerol pathway的研究论文。该研究揭示了一个新的脂质合成过程中的关键调控机制,AGPAT2与CDS1/2可直接相互作用形成稳定的功能性复合物,促进PA转变成CDP-DAG这一条脂质合成途径。

为了探究AGPAT2对脂滴形成的影响,研究者首先在不同细胞中敲降AGPAT2,发现敲降AGPAT2会出现超大脂滴(A),并且回补野生型AGPAT2而不是功能缺失突变的AGPAT2时,能挽救敲降AGPAT2带来的脂滴变大表型。鉴于敲降AGPAT2后细胞中PA的含量会显著增加,研究者猜想AGPAT2的缺失会影响脂滴形成的早期过程。为了验证这一假设,研究者通PLIN3来表明脂滴形成的最早步骤,用BODIPY来指示已获得大量中性脂质的脂滴。发现与对照相比,敲降AGPAT2后,油酸处理10分钟内Plin3斑点数量急剧增加,而BODIPY阳性脂滴却比WT细胞要少得多。这些实验都表明AGPAT2缺失不仅会增加脂滴的大小,还会阻滞脂滴的早期形成。
研究者随后探究了AGPAT2缺失细胞形成超大脂滴的原因。研究者在AGPAT2缺失细胞中进一步敲降DGAT1和2,发现敲降DGAT1和2并不能完全恢复脂滴的正常大小,表明存在区别于TAG合成并影响脂滴大小的其它机制。过去有研究发现在AGPAT2缺失细胞中PA的含量会增加,研究者通过PA报告系统也证实了这一现象,这表明PA的含量可能是影响超大脂滴形成的原因。为了验证这个假说,研究者过表达seipin, CDS1 and CDS2,来减少细胞中PA含量,发现PA含量的下降几乎完全消除了AGPAT2缺失带来的脂滴增大效应(B),表明了PA在AGPAT2缺失细胞中脂滴变大过程中的重要作用。
有意思的是,研究者在检测CDS1/2对AGPAT2缺失细胞中脂滴变大的影响时,意外发现AGPAT2的缺失会降低CDS1和CDS2蛋白的表达。进一步的实验发现AGPAT2的缺失并不会影响CDS1/2的转录水平,但降低了CDS1/2蛋白的稳定性。与蛋白水平下降一致的是,CDS1/2的蛋白活性在AGPAT2缺失细胞中也明显下降。此外,过表达AGPAT2会增加CDS1/2活性,显著减少了OA转变成TAG。研究者进一步发现AGPAT2对CDS1/2蛋白表达的影响主要是通过AGPAT2与CDS1/CDS2的直接相互作用形成了一个稳定的复合体(C),从而来调控脂质由PA到CDP-DAG的合成途径。
最后研究者构建了肝脏特异性敲除AGPAT2的小鼠,发现AGPAT2缺失,肝脏中的CDS2蛋白减低(D),PA和甘油三酯含量增加,脂滴变大,进一步验证了AGPAT2/CDS复合体在脂质代谢途径中的重要作用。总的来说,该研究揭示了AGPAT2和 CDS1/2 可以形成稳定的复合物,促进 CDP-DAG 的合成,提供了对 3-磷酸甘油途径调节的关键见解,阐明了 AGPAT2 缺陷下PA增加的分子基础和BSCL1的发病机制,并开辟未来研究如何在主要代谢分支点控制 PA 代谢的途径。
新南威尔士大学杨洪远教授为该论文的通讯作者,新南威尔士大学Hoi Yin Mak,南京大学欧阳茜和悉尼大学Sergey Tumanov为该论文的共同第一作者。
参考文献
1.Olzmann, J. A. & Carvalho, P. Dynamics and functions of lipid droplets. Nat. Rev. Mol. Cell Biol.20, 137–155 (2019).
2.Rosen, E. D. & Spiegelman, B. M. What we talk about when we talk about fat. Cell 156, 20–44 (2014).
3.Fei, W., Du, X. & Yang, H. Seipin, adipogenesis and lipid droplets. Trends Endocrinol. Metab.22, 204–210 (2011).
4.Agarwal, A. K. Lysophospholipid acyltransferases: 1-acylglycerol-3-phosphate O-acyltransferases. From discovery to disease.Curr.Opin. Lipidol.23, 290–302 (2012).
5.Bradley, R. M. & Duncan, R. E. The lysophosphatidic acid acyltransferases (acylglycerophosphate acyltransferases) family: onereaction, five enzymes, many roles.Curr. Opin. Lipidol.29, 110–115 (2018).
6.Blunsom, N. J. & Cockcroft, S. CDP-Diacylglycerol synthases (CDS): gateway to phosphatidylinositol and cardiolipin synthesis.Front. Cell Dev. Biol.8, 63 (2020).
7.Agarwal, A. K. et al. AGPAT2 is mutated in congenital generalized lipodystrophy linked to chromosome 9q34.Nat. Genet.31, 21–23(2002).
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




