▲点击上方的蓝色“医谷”关注我们

今日(10月18日),科济药业宣布,其CAR-T疗法泽沃基奥仑赛注射液提交的新药上市申请已获得国家药监局受理,用于治疗复发/难治多发性骨髓瘤。此次申请受理是基于一项在中国进行的开放、单臂I/II期临床试验(LUMMICAR STUDY 1(方案编号:CT053-MM-01))的临床试验数据。研究结果显示,泽沃基奥仑赛注射液具有良好的安全性和疗效,对伴随细胞遗传学高危的患者同样呈现出良好的治疗效果。
多发性骨髓瘤是第二大常见的血液系统恶性肿瘤,据世界卫生组织的资料,在2020年,中国有超过21000例新病例和近16200例由于多发性骨髓瘤导致的死亡病例,目前存在巨大的未满足的临床需求。泽沃基奥仑赛(Zevor-cel/CT053)是一种用于治疗复发/难治多发性骨髓瘤的全人抗自体BCMA CAR-T细胞候选产品,其中BCMA是一种在血液中的恶性和正常浆细胞表面均表达的蛋白,泽沃基奥仑赛构建体利用全人抗BCMA单链抗体域,推测可以降低免疫原性并提高安全性。
2019年,泽沃基奥仑赛获得美国FDA的再生医学先进疗法(RMAT)及孤儿药称号,以及先后于2019年及2020年获得欧洲药品管理局(EMA)的优先药物(PRIME)及孤儿药产品称号,2020年及今年,又被国家药监局先后纳入突破性治疗药物品种以及拟优先审评名单。
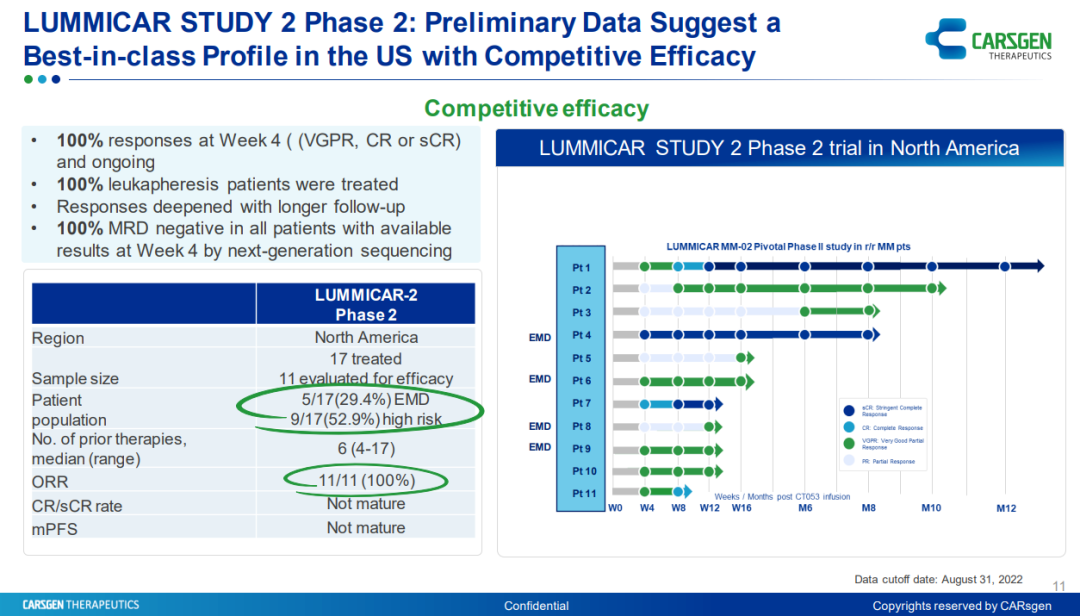
今年9月,科济药业在第七届CAR-TCR年度峰会上公布了一项II期临床试验的初步结果。截至2022年8月31日,17名复发/难治多发性骨髓瘤患者在该临床试验中接受泽沃基奥仑赛输注,且中位随访时间113天。结果显示,在11名至少8周随访的可评估的患者中,4例患者伴随EMD,11例患者客观缓解率为100%(非常好的部分缓解、完全缓解或严格完全缓解),并在更长时间的随访观察到更深的缓解。由于所有的缓解都在进行中,中位无进展生存期、中位生存期和中位缓解持续时间尚未达到,并且完全缓解/严格完全缓解率尚未成熟。所有的在第四周有MRD结果的患者,通过二代测序MRD均为阴性。安全性方面,没有出现死亡,没有患者经历过3级或者更高的细胞因子释放综合征。
截止目前,全球共2款靶向BCMA的CAR-T产品上市,即BMS的Abecma和传奇生物的西达基奥仑赛,此外,信达生物和驯鹿医疗合作开发的伊基仑赛已于今年6月在国内申报上市,这也是国内首家递交新药上市并获受理的靶向BCMA的CAR-T疗法,目前正处于审评阶段。
文 | 医谷
推荐阅读
《艾滋病基因疗法首例人体试验启动,有望实现“一次治疗、终身治愈”》
了解“生物医药‘明日之星’第二季评选活动暨2022张江细胞与基因治疗产业创新创业大赛”更多详情,请点击这里
 更多关于张江细胞产业园,请点击这里
更多关于张江细胞产业园,请点击这里

医谷:拥有最全医学大健康产业信息来源渠道,紧跟政策风向,传播最新行业资讯;聚集国内外知名投资机构投资人,挖掘跟踪创新项目,实现项目资本快速对接;网罗大量会展信息及展后报道,聚焦热门产品技术,阐述专家大咖独到见解。

寻求广告投放、会议合作、企业传播等请联系400-689-7892。



 个人中心
个人中心
 我是园区
我是园区






