纪家葵团队建立新型减数分裂荧光报告系统并揭示生殖细胞与性腺体细胞的互作机制
收藏
关键词:
揭示细胞
资讯来源:BioArt + 订阅账号
发布时间:
2021-09-26

有性繁殖物种的成熟生殖细胞中染色体数量是体细胞的一半,并且其染色体序列与亲代细胞不完全相同,这些变化是通过减数分裂来实现的,而生殖细胞在第一次减数分裂前期经历了许多减数分裂特有的发育调控过程。细胞类型特异性或发育阶段特异性的荧光报告系统可以为目的细胞在特定发育阶段的研究提供便利,但目前已有的在小鼠减数分裂期间表达的荧光报告小鼠模型中,荧光信号的表达与减数分裂进程的一致性不高
【1-4】
。另外,虽然哺乳动物雄性和雌性减数分裂生殖细胞的发育依赖于性腺体细胞提供的完全不同的微环境,但减数分裂过程中生殖细胞和性腺体细胞的互作机制还不明了。
2021年9月7日,清华大学纪家葵团队在PLOS Genetics杂志发表题为
IGSF11 is required for pericentric heterochromatin dissociation during meiotic diplotene
的研究论文,
建立了新型减数分裂荧光报告系统并揭示生殖细胞与性腺体细胞的互作机制。
根据联会复合体的组装状态的不同,第一次减数分裂前期主要分为细线期、偶线期、粗线期和双线期。为了更方便地研究生殖细胞第一次减数分裂前期的发育过程,该研究首先利用CRISPR/Cas9介导的基因编辑技术,通过将荧光蛋白报告基因插入联会复合体蛋白SYCP3的翻译起始位点,构建了减数分裂生殖细胞荧光报告系统(VPHS)。经检测,带有VPHS报告系统的转基因小鼠生殖能力或SYCP3的表达等功能与野生型小鼠无明显差异,并且报告基因的荧光信号能有效指示减数分裂的启动和进行
(图1)
。该成果为小鼠减数分裂期间的相关研究提供了具有普遍适用性的新平台。
图1. 小鼠生殖细胞减数分裂荧光报告系统。第一次减数分裂前期各阶段初级精母细胞的分选鉴定。
随后,该研究发现免疫球蛋白超家族粘附分子IGSF11缺失会导致初级精母细胞发育阻滞,进而导致小鼠雄性不育。出生后小鼠的曲细精管中,Igsf11在睾丸支持细胞及多个发育阶段的生精细胞中均有表达。为研究睾丸支持细胞和生精细胞来源的IGSF11对于初级精母细胞发育的贡献,该研究使用睾丸注射细胞移植技术进行不同Igsf11基因型的供体细胞及受体小鼠的组合实验,并使用构建好的减数分裂荧光报告系统检测供体细胞在受体小鼠睾丸中的发育情况。结果显示,睾丸支持细胞和生精细胞来源的IGSF11对于小鼠初级精母细胞的正常发育均是必不可少的,上述任何一方缺失IGSF11后初级精母细胞均会停滞在第一次减数分裂前期
(图2)
。该论文研究成果证明在第一次减数分裂前期存在基于性腺体细胞与生殖细胞互作的至关重要的调控机制。
图2. 睾丸细胞注射移植实验模式图和基于VPHS报告系统的初级精母细胞发育进程检测。
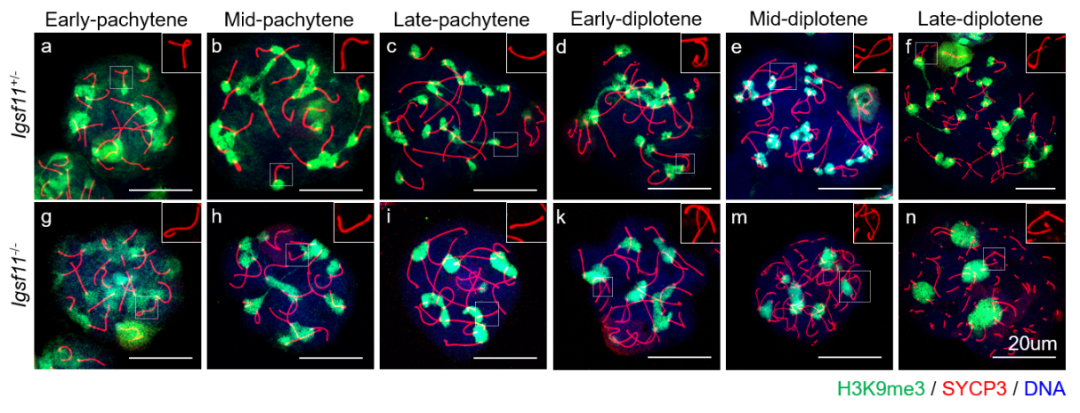
进一步研究IGSF11缺失对于初级精母细胞发育的影响后发现,这些细胞可以通过粗线期检验点,联会复合体染色提示其可以发育到达双线期。但是从粗线期晚期开始,IGSF11缺失的初级精母细胞中非同源染色体的近着丝粒染色质发育异常,不能彼此分离
(图3)
。以往发现的对于减数分裂至关重要的蛋白主要作用于染色体臂、端粒或着丝粒区域,该研究却发现近着丝粒区域同样存在对于减数分裂至关重要的调控机制。
图3. 不同Igsf11基因型小鼠初级精母细胞的发育进程检测。
该研究由清华大学医学院纪家葵教授实验室
(博士生陈波、严安、何京、李琳)
,清华大学免疫学研究所董晨实验室
(博士生朱庚振)
以及清华大学生命科学学院杨雪瑞实验室
(博士生刘阳)
合作完成。
https://doi.org/10.1371/journal.pgen.1009778
1. Brown, P.R., Odet, F., Bortner, C.D., and Eddy, E.M. (2014). Reporter mice express green fluorescent protein at initiation of meiosis in spermatocytes. Genesis 52, 976-984.
2. Enguita-Marruedo, A., Van Cappellen, W.A., Hoogerbrugge, J.W., Carofiglio, F., Wassenaar, E., Slotman, J.A., Houtsmuller, A., and Baarends, W.M. (2018). Live cell analyses of synaptonemal complex dynamics and chromosome movements in cultured mouse testis tubules and embryonic ovaries. Chromosoma 127, 341-359.
3. Nayernia, K., Li, M., Jaroszynski, L., Khusainov, R., Wulf, G., Schwandt, I., Korabiowska, M., Michelmann, H.W., Meinhardt, A., and Engel, W. (2004). Stem cell based therapeutical approach of male infertility by teratocarcinoma derived germ cells. Hum Mol Genet 13, 1451-1460.
4. Tadokoro, Y., Yomogida, K., Yagura, Y., Yamada, S., Okabe, M., and Nishimune, Y. (2003). Characterization of histone H2A.X expression in testis and specific labeling of germ cells at the commitment stage of meiosis with histone H2A.X promoter-enhanced green fluorescent protein transgene. Biol Reprod 69, 1325-1329.
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。





 药选址
药选址




