
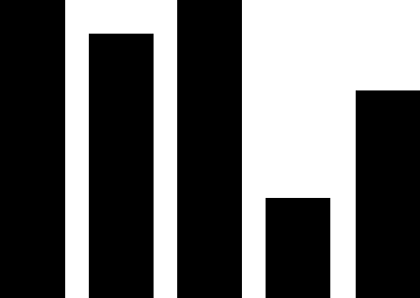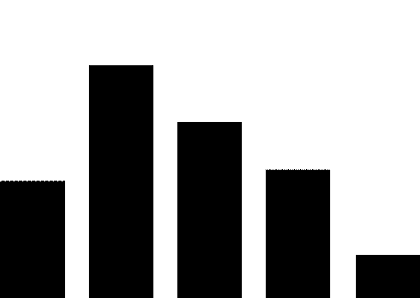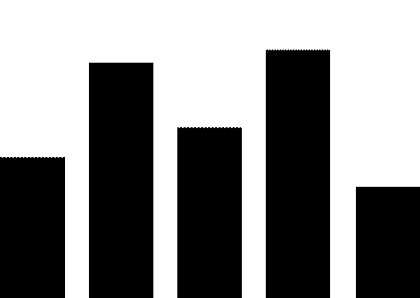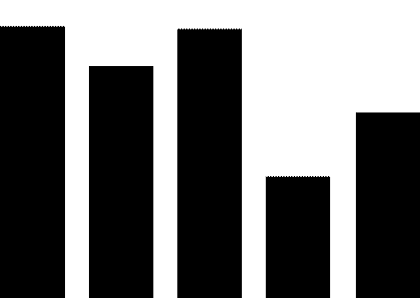
2012年7月,美国食品和药物管理局(FDA)首次创建“Breakthrough Therapy”(突破性疗法),旨在加速开发及审查治疗严重、威胁生命的疾病的新药。Breakthrough Therapy成为继Fast Track(快速通道)、Accelerated Approval(加速批准)、Priority Review(优先审评)后美国FDA的第四条特别审批通道。
Breakthrough Therapy与Fast Track最为类似,却有更高的“含金量”,其对药物的筛选更为严格,它要求初步临床试验表明,药物在一个或多个有临床意义的指标上,较现有疗法有显著改善。使用该渠道不但享有“快速通道”的所有权利,还能得到美药管局从Ⅰ期临床试验开始的格外关照,这意味着获得美国FDA突破性疗法的认定,往往预示着该药物更高的上市可能性。
01
我国的突破性治疗
2019年11月,我国国家药品监督管理局药品审评中心(CDE)起草了《突破性治疗药物工作程序》(征求意见稿),对标国外突破性疗法Breakthrough Therapy,对具有明显临床优势的药物,在药物临床试验的研制过程中,给予技术指导、全过程沟通等支持政策,以加快药物研制和上市进程。
2020年7月,突破性治疗通道开启后,截至目前药审中心网站最新信息显示,已有四十几个新药被纳入突破性治疗品种。
02
突破性治疗的适用范围?
突破性治疗的适用范围明确了纳入突破性治疗药物程序需满足两个条件:
▨ 一是用于防治严重危及生命的或者严重影响生存质量的疾病。严重疾病是指关系患者的生存,病情发展不可逆,显著影响日常生理功能的疾病,如果不治疗会更加严重。
▨ 二是对于尚无有效防治手段的,该药物可以提供有效防治手段;或,与现有治疗手段相比,该药物具有明显临床优势,即单用或与一种或多种其他药物联用,在一个或多个有临床意义的疗效指标上有显著改善。
突破性治疗是适应症申请,例如纳入拟突破性治疗品种名单耐克替尼片,其注册申请人为广州顺健生物医药科技有限公司,此前,耐克替尼用于治疗酪氨酸激酶抑制剂(TKI)耐药后并伴有T315I突变的慢性髓性白血病(CML)慢性期或加速期的成年患者的上市申请已获CDE优先审评资格。
此次拟纳入突破性疗法的适应症属于扩展适应症,用于治疗一代和二代酪氨酸激酶抑制剂耐药和/或不耐受的慢性期慢性髓性白血病患者。

03
走突破性治疗通道有哪些好处?
突破性治疗最大的好处是审批加速,申请人提交的突破性治疗药物程序申请后,60个工作日内即可收到审核结果,特殊情况需延长审核时限的,延长的时限原则上不超过30个工作日。
另一大优势是关于临床试验期间的支持政策。药审中心对纳入突破性治疗药物程序的品种,加强指导并促进药物研发进程,优先处理相关沟通交流。
申请人可以在纳入程序的6个月按Ⅰ类会议申请首次沟通交流,全面讨论药物临床、药学及药理毒理等方面的研发进展、计划以及遇到的相关问题。申请人可以提交阶段性研究资料,药审中心及时提出意见或者建议,促进研发、加快上市进度。
04
突破性治疗公示和拟公示结果分析
截止到2021年3月24日,我们统计了药审中心纳入和公示拟纳入突破性治疗的总计45个药品。
癌症作为最为严重且威胁生命的疾病,包揽了超过半数的突破性治疗公示和拟公示药品,这31个抗肿瘤药中化学药品数量超过一半,其余为生物制品。抗病毒药、免疫抑制剂和抗癫痫药也有一定数量品种获纳入及拟纳入突破性治疗,但数量远低于第一名抗肿瘤药。

药审中心纳入和拟纳入的突破性治疗药品中,国产药品有25个,进口药品20个。分析申请突破性治疗的企业所在地,结果发现这些企业多集中于上海、苏州、南京等江沪地区,广东和京津地区有少量企业,剩余零散分布于其他地区。
究其原因,可能是长三角地区对医药产业具有更大的政策扶持力度,发达的经济也为新药的研发提供了更多的资金支持,有利于形成医疗产业集群,如张江药谷和苏州BioBAY等已经形成较大规模的医药产业园区又可反过来带动整个地区的医药产业发展,足以为新药研发提供肥沃的土壤。

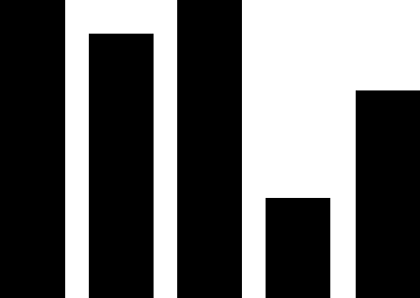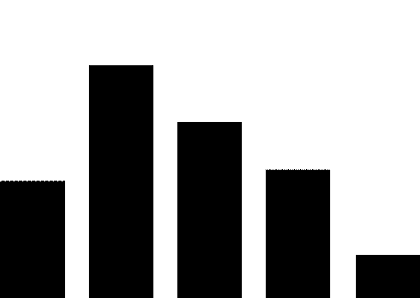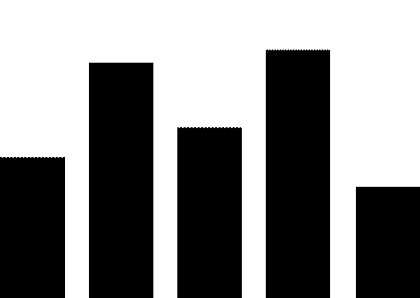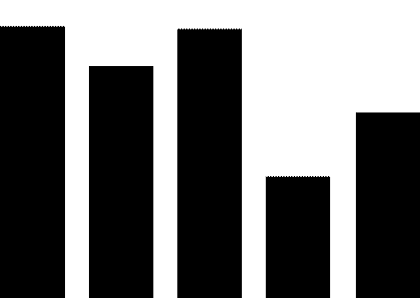
4.24-25,扬州 · 国际会议中心
▲ 本次会议安排了5场写意讨论,几十位创新企业掌门人,分别针对化学药和生物药开发,投资与创新,CRO/CDMO赋能创新,就药企的转型升级的热点问题进行深度研讨。




 个人中心
个人中心
 我是园区
我是园区




