
撰文 | 我的闺蜜老红帽
单细胞相关技术是研究生物体这一复杂系统的有力武器
【1】
。当然,这一技术的局限性在于只能提供细胞状态的一个剪影,并不能显示细胞的动态运转规律。因此,单细胞相关技术的发展趋势是进一步体现细胞动力学特征,这有助于揭示细胞活动以及与功能之间的关系。靶向肿瘤的免疫细胞在临床上具有重要且广泛的应用
【2】
,研究这类细胞正需要上述技术。T细胞疗法在血液恶性肿瘤治疗方面已经取得了长足进展,并且还应用到了治疗实体肿瘤上,但是其效率仍有待提高
【3】
。这就需要更加深入的了解在T细胞疗法起作用过程中的活动规律和机制,从而可以更加优化治疗策略。
目前可用的靶向肿瘤的T细胞疗法包括嵌合抗原受体
(chimeric antigen receptor,简称
CAR
)
疗法
【4】
,传统T细胞受体疗法
【5】
,以及表达γδ TCR的αβT细胞疗法
(简称
TEGs
)
【6】
,后者疗法通常是通过感应细胞代谢水平来识别肿瘤细胞的
【7,8】
。目前,来源于病人的肿瘤类器官在模拟免疫治疗动力学表征上已经得到广泛应用,其原因主要是肿瘤类器官携带最初肿瘤样本的重要信息,包括对治疗方案的响应情况。与此同时,成像技术可以在三维层面重塑其空间细胞结构以及组织动力学情况。当然,这一技术还没有应用在来源于实体瘤的类器官上。
近日,来自荷兰Royal Netherlands Academy of Arts and Sciences and University Medical Center Utrecht 的Anne C. Rios研究组在Nature Biotechnology上发表题为
Uncovering the mode of action of engineered T cells in patient cancer organoids
的文章,
结合类器官和三维成像等技术,研究免疫疗法对实体瘤等的治疗情况。
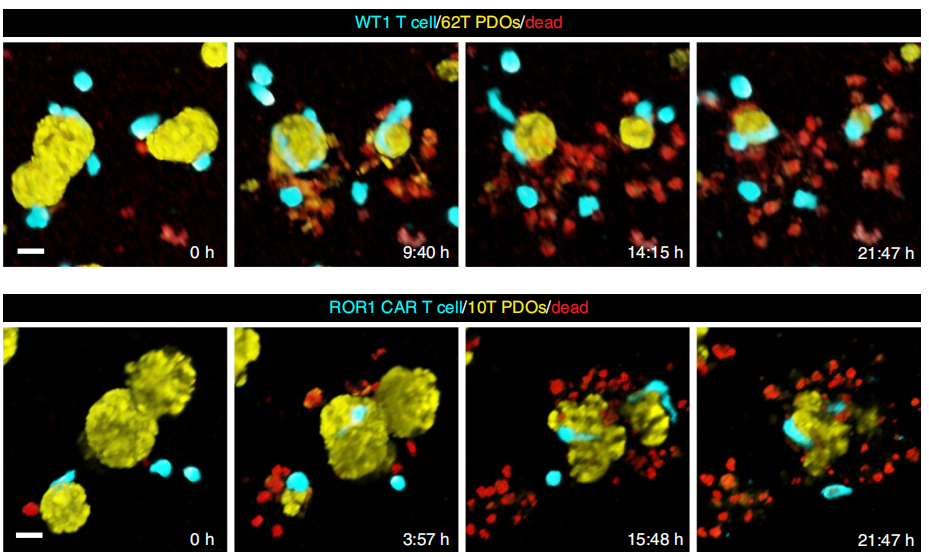
首先,作者搭建了BEHAV3D这一多谱段的三维成像平台,用以同时监测近60组病人肿瘤类器官进行免疫治疗的效率和模式。作者发现TEGs疗法治疗实体瘤的疗效不错,并且可以无差别靶向乳腺癌病灶,虽然不同的病人还是存在一定差异性的。作者还通过肿瘤类器官RNA测序等方法确定,肿瘤类器官可以全方位模拟肿瘤以及治疗情况。
接下来,作者研究TEG疗法的具体效果。作者确定,TEGs持续杀伤肿瘤细胞依赖与其与肿瘤类器官的直接接触。BEHAV3D平台的高时空分辨率可以充分展示CD8+TEGs的杀伤情况以及形态变化。作者还通过单细胞测序发现,CD8+TEGs表法不同水平的I型神经细胞粘附因子
(neural cell adhesion molecule1,简称
NCAM1
)
,并且,与NCAM1阴性TEGs相比,分选的NCAM1阳性TEGs杀伤乳腺癌类器官的水平更强。这也说明,细胞所表达的表面分子也很可能与T细胞疗法的效率相关。
最后,作者在转录水平研究TEGs的作用机理。作者通过对与乳腺癌类器官共培养后的TEGs进行单细胞测序,发现在共培养6小时后,各TEGs亚群,包括效应性CD8+T、效应性CD4+T和记忆性CD4,转录组均发生明显变化,且这些亚群转录组变化具有高度保守性。这些变化的功能模块包括CD3信号通路和NFkB信号通路等。作者进一步分析定义了一组具有杀伤功能的TEGs特异性的分子特征标签,这组标签包含61个基因,其中20个与T细胞活化和细胞毒性相关,14个参与T细胞其它功能,另外27个之前并没有报道与T细胞功能相关,在这27个基因中有17个与细胞形态变化相关,这些基因可能与细胞转移入侵等相关。另外,作者还确定I型干扰素参与类器官对TEGs杀伤作用的耐受过程。
综上所述,
作者搭建了名为BEHAV3D的成像平台,整合了三维成像和转录组学工具,用以研究免疫细胞和病人肿瘤类器官之间的相互作用。作者通过研究与病人实体瘤类器官共培养的T细胞,发现和定义了一组杀伤功能相关的基因标签,并且说明BEHAV3D是研究细胞免疫疗法治疗过程的有效工具。
https://doi.org/10.1038/s41587-022-01397-w
制版人:十一
1. van der Leun, A. M., Thommen, D. S. & Schumacher, T. N. CD8(+) T cell states in human cancer: insights from single-cell analysis. Nat. Rev. Cancer 20, 218–232 (2020).
2. June, C. H. & Sadelain, M. Chimeric antigen receptor therapy. N. Engl. J. Med. 379, 64–73 (2018).
3. Chen, D. S. & Mellman, I. Elements of cancer immunity and the cancer-immune set point. Nature 541, 321–330 (2017).
4. Wallstabe, L. et al. ROR1-CAR T cells are effective against lung and breast cancer in advanced microphysiologic 3D tumor models. JCI Insight 4, e126345 (2019).
5. Chapuis, A. G. et al. T cell receptor gene therapy targeting WT1 prevents acute myeloid leukemia relapse post-transplant. Nat. Med. 25, 1064–1072 (2019).
6. Grunder, C. et al. gamma9 and delta2CDR3 domains regulate functional avidity of T cells harboring gamma9delta2TCRs. Blood 120, 5153–5162 (2012).
7. Vyborova, A. et al. gamma9delta2T cell diversity and the receptor interface with tumor cells. J. Clin. Invest. 130, 4637–4651 (2020).
8. Rigau, M. et al. Butyrophilin 2A1 is essential for phosphoantigen reactivity by gammadelta T cells. Science 367, eaay5516 (2020).
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。








 个人中心
个人中心
 我是园区
我是园区




