
声明:本文为火石创造原创文章,欢迎个人转发分享,网站、公众号等转载需经授权。
2022年2月,全球批准新药数量减少。FDA批准10款新药(NDA/BLA),包含2款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),2款生物制品药物(BLA);EMA新授权4款药品上市,其中Saphnelo为一款first-in-class药物,为系统性红斑狼疮(SLE)开创了新的疗法;NMPA本月未批准创新药上市。
医疗器械方面,FDA没有通过上市前批准(PMA)途径首次上市的产品。境内公示了7个三类医疗器械进入创新审批绿色通道,批准了1个创新器械上市,国内医疗器械审批集中在体外诊断试剂,共265项,占21.32%。
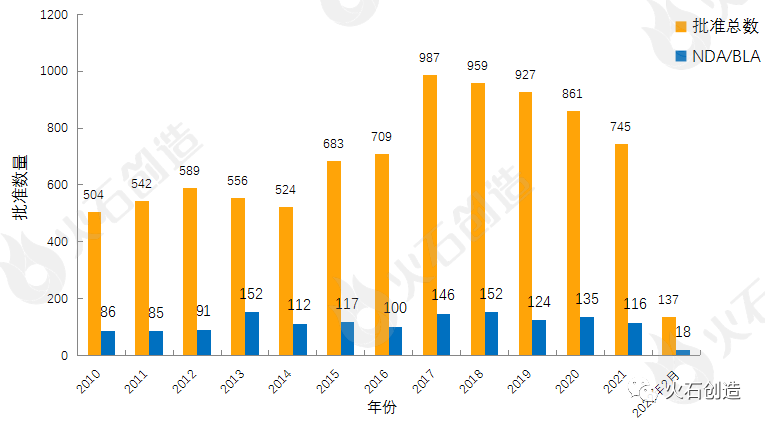
图1:2010—2022年2月FDA药物批准数量变化情况
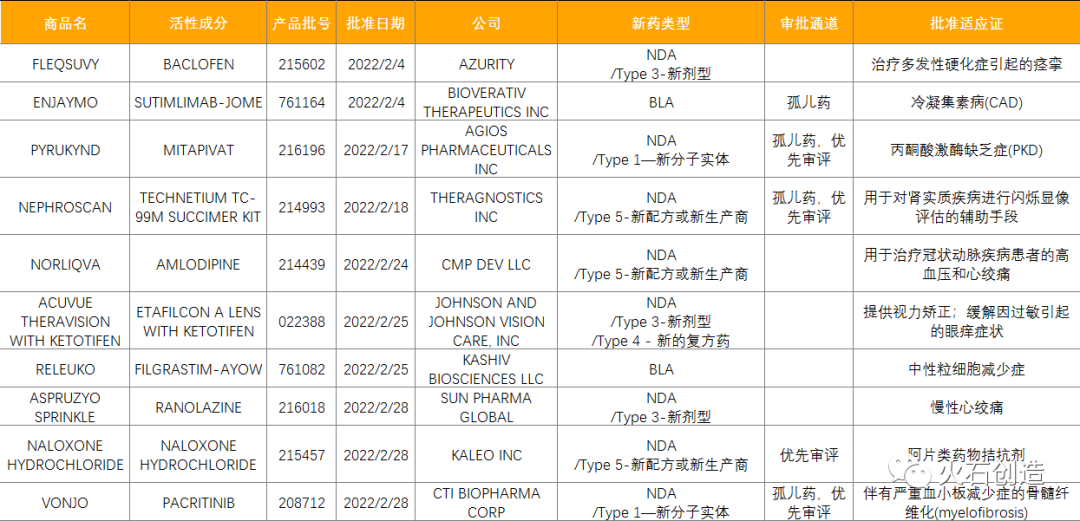
如图1,截至2022年3月4日FDA官网披露,2022年2月FDA共完成68项药品首次批准(不包含暂时批准),其中NDA/BLA批准10款(不包含暂时批准),见表1。其中包括2款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),2款生物制品药物(BLA)。
其中ENJAYMO为补体C1s抑制剂,是首个也是唯一一个被批准用于治疗冷凝集素病(CAD)的药物,其活性成分SUTIMLIMAB是一款first-in-class人源化单克隆抗体,此前,FDA已授予SUTIMLIMAB突破性药物资格和孤儿药资格;PYRUKYND是一款首创口服丙酮酸激酶(PK)激活剂,也是丙酮酸激酶缺乏症(PKD)首个疾病修正疗法,用于治疗PKD成人患者溶血性贫血;ACUVUE THERAVISION WITH KETOTIFEN是强生全视旗下全球首个且唯一可同时矫正视力并缓解过敏性眼痒的药物缓释隐形眼镜(全球首个药械组合型隐形眼镜),该产品曾于2021年3月获得日本厚生劳动省的审批。
表1:2022年2月FDA批准NDA/BLA药物列表
截至2022年3月4日EMA官网披露,2012年至2022年2月的推荐上市药品及新活性物质(NAS)数量情况见图2。2022年2月EMA无推荐药品上市。
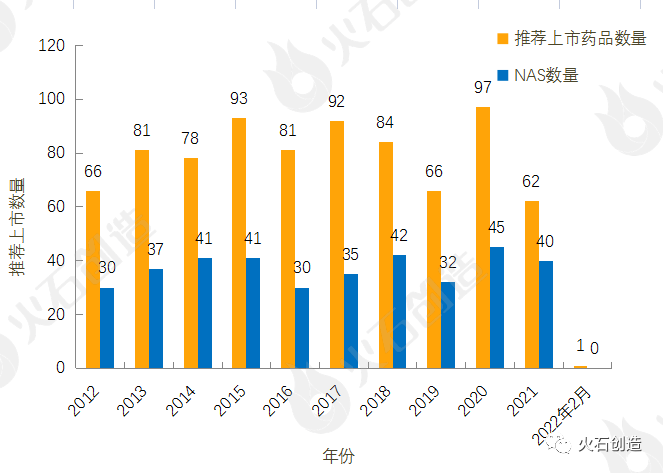
图2:2012—2022年2月EMA推荐上市药品数量变化情况
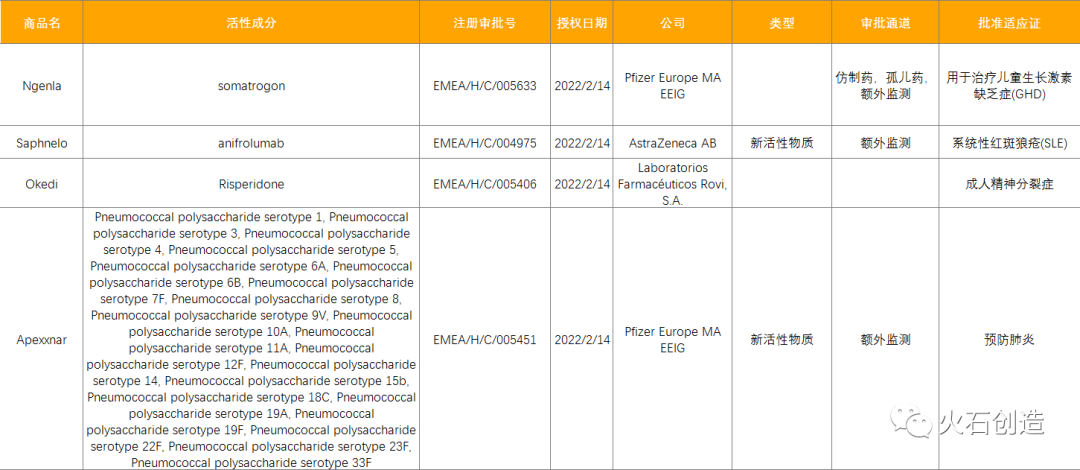
截至2022年3月4日,EMA在2月新授权4款药品上市,见表2。其中阿斯利康的first-in-class药物Saphnelo是首个I型干扰素(I型IFN)受体拮抗剂,也是过去近10年来第一个治疗系统性红斑狼疮(SLE)的新疗法,该产品于2021年8月获得FDA上市批准;Apexxnar为20价肺炎球菌结合疫苗(PCV20),是下一代肺炎球菌结合疫苗,2021年6月曾获得FDA上市批准,商品名PREVNAR 20,这是欧盟EMA首次批准一种结合疫苗,可预防20种血清型引起的大多数侵袭性肺炎球菌病和肺炎。
截至2022年3月4日NMPA披露,2022年2月共批准国产首次注册药品25件。按剂型去重后,共20个药品品种(不同厂家生产同一药物按同一品种计算)。本月NMPA未批准创新药上市。
截至2022年3月4日CDE官网披露,CDE共承办药品一致性评价受理号3742个,2022年2月共新增承办65个受理号。截至2022年3月4日,共3741个品规上市药品通过一致性评价(包含视同通过1496个品规),本月共53个品规的药品通过一致性评价(包含视同通过4个品规),按剂型去重后,共36个药品品种。
目前一致性评价品种通过的注射剂共 1223个品规(191个品种),本月过评药品中共计31个品规(17个品种)的注射剂。2018年至2022年2月通过一致性评价数量见图3。
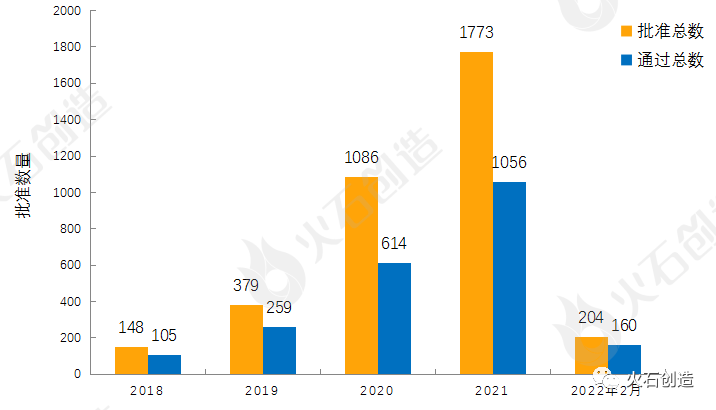
图3:2018年至2022年2月仿制药一致性评价批准数量变化情况
截至2022年3月7日,2月FDA共批准202个510(k)途径的产品,其中一类器械20个,二类器械176个,未分类6个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,2月产品获批类型最多的为一般和整形手术器械、一般医院和个人使用类器械、放射科器械、骨科器械与心血管器械,见图4。
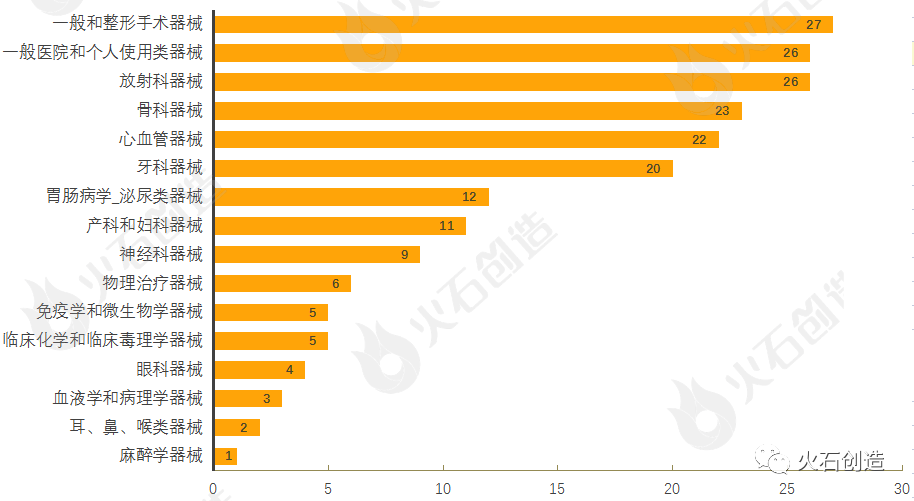
图4 :2022年2月通过FDA 510(k)途径获批上市产品类型分布情况
2022年2月没有通过上市前批准(PMA)途径首次上市的产品。
截至2022年3月7日,2022年2月国家局公示了7个三类医疗器械进入创新审批绿色通道,见表3。
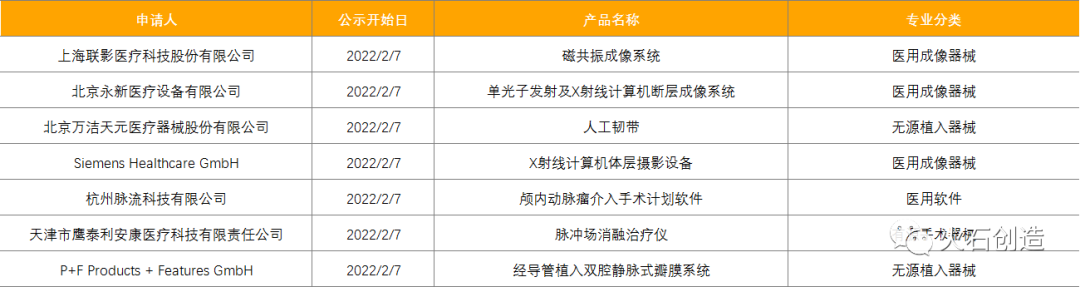
截至2022年3月7日,2022年2月国家局公示了1个三类创新器械获批上市,见表4。

截至2022年3月7日,2022年2月国家局共批准首次注册三类医疗器械产品178个,其中国产138个,进口40个。各省级药品监管部门2月共批准国产第二类医疗器械注册494个,一类备案医疗器械535个。
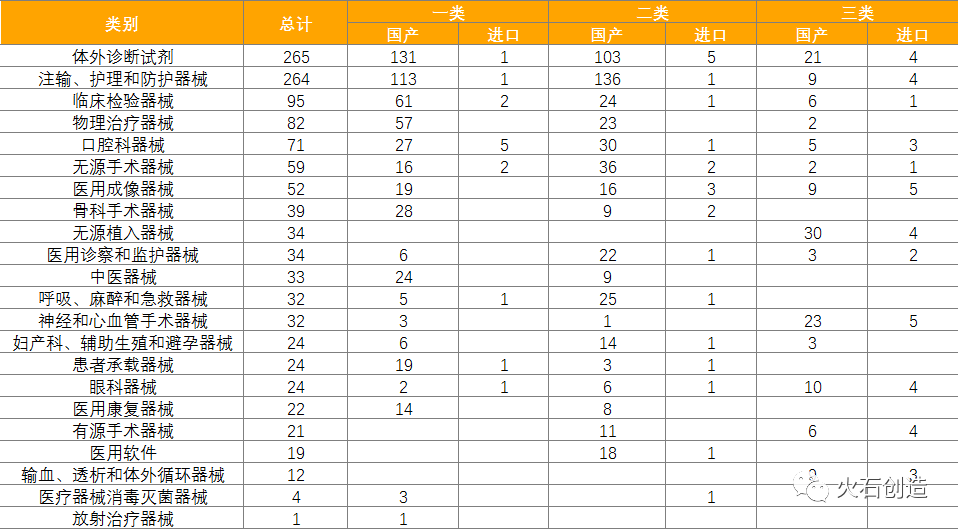
统计数据显示,体外诊断试剂数量最多,共265项,占21.32%,基本上均为国产,为255项。除体外诊断试剂,批准注册类别数量排前三位的分别为注输、护理和防护器械,临床检验器械和物理治疗器械。
表5:2022年2月国产、进口医疗器械批准注册类别数目分布情况
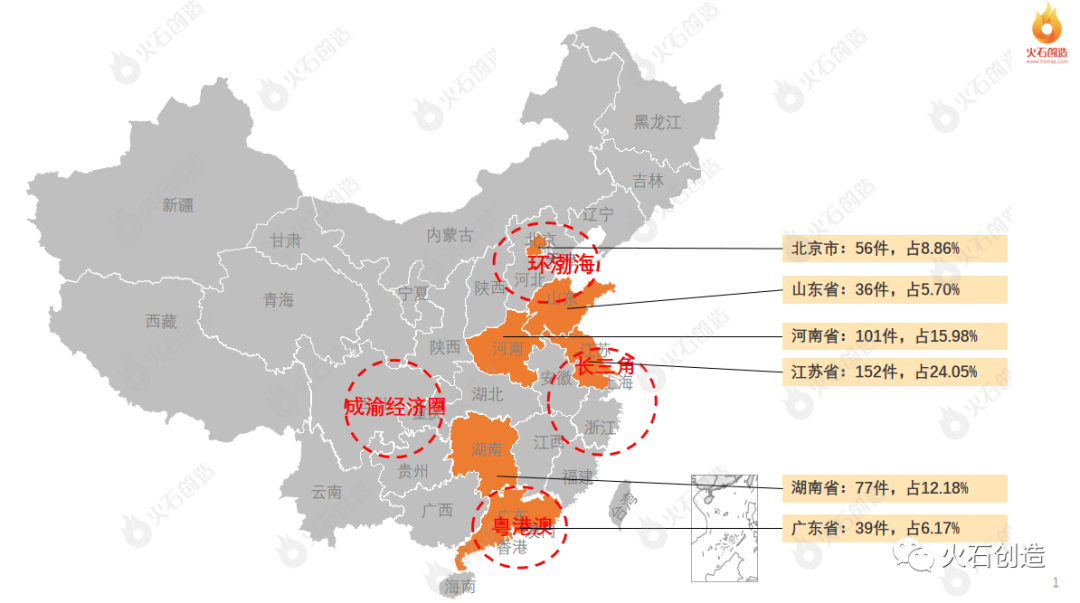
从地域分布上,2022年2月国产二、三类注册产品批件最多的依次为江苏省(152件)、河南省(101件)、湖南省(77件)三个区域,见图5。
如需转载,请留言申请或邮件至contact@hsmap.com处理
如果您也在思考如何用数据驱动产业高质量发展,欢迎来电咨询:400-656-6867
火石产业大脑赋能政府侧、服务市场侧
数据驱动产业发展,就找「火石创造」
▼点击下方【阅读原文】,获取「产业大脑解决方案」













 药选址
药选址











