精彩内容
近期,复星医药3款以仿制4类报产的仿制药、1款以新药3类报产的创新药进入行政审批阶段。益基利仑赛注射液(拟定)有望成为国内首款获批上市的CAR-T产品,注射用帕瑞昔布钠、替格瑞洛片在2019年中国公立医疗机构终端的销售额均超过10亿元。
复星医药近期进入行政审批的产品
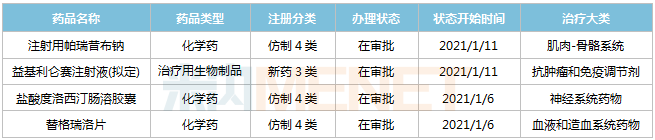
来源:米内网MED2.0中国药品审评数据库
1款创新药即将获批上市。益基利仑赛注射液(拟定),代号FKC876,是复星凯特从美国Kite Pharma引进并获授权在中国进行本地化生产的靶向CD19自体CAR-T细胞治疗产品,该产品于2017年10月18日获得FDA批准上市,用于治疗复发难治性大B细胞淋巴瘤。
2020年2月26日,益基利仑赛注射液(拟定)的上市申请获得CDE承办受理,同年3月以“具有明显治疗优势药品”为由纳入优先审评审批,2021年1月进入行政审批阶段,意味着国内首款CAR-T产品即将获批上市!该产品自申报上市到即将获批,仅用不到一年时间。
3款仿制药即将获批生产,分别为注射用帕瑞昔布钠、盐酸度洛西汀肠溶胶囊及替格瑞洛片,3款仿制药均以新分类报产,获批生产后将视同通过一致性评价。
米内网数据显示,在2019年中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端,注射用帕瑞昔布钠销售额接近20亿元,目前已有12家企业过评;盐酸度洛西汀肠溶胶囊销售额超过6亿元,目前已有5家企业过评;替格瑞洛片销售额超过15亿元,目前已有10家企业过评。
来源:米内网数据库
注:数据统计截至1月14日,如有疏漏,欢迎指正!
本文为原创稿件,转载请注明来源和作者,否则将追究侵权责任。
投稿及报料请发邮件到495903287@qq.com
稿件要求详询米内微信首页菜单栏
商务及内容合作可联系QQ:412539092



 个人中心
个人中心
 我是园区
我是园区




