▎药明康德内容团队报道
4月15日,中国国家药监局药品审评中心(CDE)官网公示,强生(Johnson & Johnson)旗下杨森公司(Janssen)的CD38单抗达雷妥尤单抗注射液(皮下注射)在中国递交了一项新适应症上市申请,并获得受理。公开资料显示,达雷妥尤单抗皮下注射剂型可以在大约3到5分钟内给药,与该产品静脉注射剂相比,能够将患者的给药时间从几小时缩短到几分钟。此前,该产品已在中国获批用于原发性轻链型淀粉样变患者。
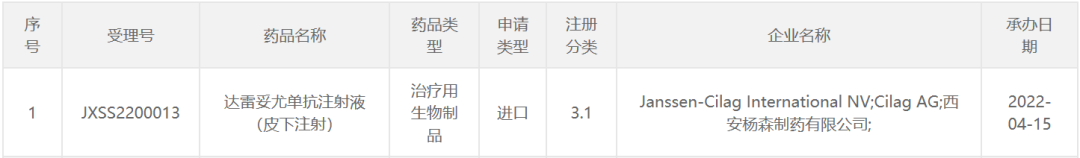
截图来源:CDE官网
公开资料显示,杨森公司的达雷妥尤单抗(daratumumab)是全球首个获批的靶向作用于CD38的全人源单克隆抗体。
研究显示,达雷妥尤单抗能够以高亲和力的方式,特异性识别在多发性骨髓瘤恶性浆细胞上高表达的CD38,进而通过多种免疫介导机制来诱导肿瘤细胞的死亡。此前,达雷妥尤单抗静脉注射剂型已在中国获批用于治疗多发性骨髓瘤患者。
达雷妥尤单抗皮下注射剂(英文商品名:Darzalex Faspro)是由达雷妥尤单抗和重组人透明质酸酶PH20(rHuPH20)组成的固定剂量复方。rHuPH20是Halozyme Therapeutics公司基于Enhanze药物递送技术而开发,它可以降解体内的透明质酸,以帮助皮下注射药物的渗透和吸收。
在中国,达雷妥尤单抗皮下注射剂于2021年10月通过优先审评获得批准上市,用于与硼替佐米、环磷酰胺和地塞米松联合用药治疗新诊断的原发性轻链型淀粉样变患者。根据中国药物临床试验登记与信息公示平台,目前杨森公司正在开展一项在中国多发性骨髓瘤受试者中评估达雷妥尤单抗皮下注射剂(JNJ-54767414)的1期、开放性、多中心研究,以评价其安全性和药代动力学特征。目前,该试验已完成患者招募。
在美国,达雷妥尤单抗皮下注射剂已获得FDA批准用于轻链型淀粉样变患者和多种多发性骨髓瘤患者。其中,该产品用于多发性骨髓瘤患者的疗效和安全性,已在名为COLUMBA的3期临床研究和名为PLEIADES的2期临床研究中取得积极结果。
在COLUMBA试验中,
与静脉注射达雷妥尤单抗相比,皮下注射剂的
总缓解率(ORR)达到非劣效性标准(分别为41%和37%),且皮下注射给药相关不良事件(ARRs)也减少了近三分之二(分别为13%和34%)
。
在PLEIADES研究中,达雷妥尤单抗皮下注射剂
与硼替佐米、美法仑和泼尼松联合使用,在新诊断的不适合移植的患者中
观察到了客观缓解
。
此外,在已接受过前期治疗的复发或难治性患者群体中,达雷妥尤单抗皮下注射剂与来那度胺和地塞米松的联合治疗也观察到了客观缓解。
多发性骨髓瘤是一种由于骨髓中的浆细胞癌变而导致的恶性血液癌症。癌变的浆细胞在骨髓中迅速扩散,并影响正常血细胞的生成,导致血细胞指数下降、骨骼损坏和肾脏损伤。过去十几年,创新疗法的不断出现革新了多发性骨髓瘤的治疗方式。然而,很多患者在获得缓解之后疾病仍然会复发,并且对已有疗法产生耐药性,该领域仍然存在未被满足的临床需求。
希望杨森公司达雷妥尤单抗注射液(皮下注射)新适应症能够早日在中国获批,为更多患者带来更佳的治疗选择。
参考资料:
[1] 中国国家药监局药品审评中心(CDE)官网. Retrieved Apr 15,2022. From https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026d
[2] 杨森宣布全球首个原发性轻链型淀粉样变治疗药物兆珂速®在华获批 . Retrieved Oct 16,2021, from https://mp.weixin.qq.com/s/FeJKJegdBKeIJp0wENQyeg
[3] U.S. Food and Drug Administration Approves DARZALEX FASPRO™ (daratumumab and hyaluronidase-fihj), a New Subcutaneous Formulation of Daratumumab in the Treatment of Patients with Multiple Myeloma. Retrieved 2020-05-04, from https://www.janssen.com/us-food-and-drug-administration-approves-darzalex-fasprotm-daratumumab-and-hyaluronidase-fihj-new
[4]
在中国多发性骨髓瘤受试者中评估Daratumumab皮下给药的临床研究. Retrieved Apr 15,2022. From
http://www.chinadrugtrials.org.cn/clinicaltrials.searchlistdetail.dhtml
本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。







 个人中心
个人中心
 我是园区
我是园区




