Cell Research | 朱继东团队提出靶向SRC-1相分离抑制YAP致癌转录活性新策略
收藏
关键词:
Cell靶向癌新策略
资讯来源:BioArt + 订阅账号
发布时间:
2021-04-17
近年来,大量的研究工作表明,液液相分离
(liquid-liquid phase separation)
在各种正常生理过程中发挥重要作用
【1-3】
,其异常变化也与人类多种重大疾病的病理过程密切相关,包括肿瘤、神经退行性疾病和自身免疫性疾病等
【4-7】
。传统的药物开发理念遵循针对已知结构的靶点蛋白进行“量体裁衣”的策略,而对于很多带有大量无序区域
(Intrinsically disordered regions, IDRs)
,缺乏折叠良好结构的蛋白,没有合适有效的靶向口袋及开发策略,这一类蛋白通常被认为是”不可靶向的
(undruggable)
”。目前的一些研究发现许多传统认为”不可靶向的
(undruggable)
”蛋白可以通过液液相分离来行使关键功能,并且它们在人类疾病中扮演重要角色,例如与肿瘤密切相关的转录因YAP和β-catenin等
【8,9】
。因此,对这些靶蛋白凝集体的研究工作将为开发药物调节这类“不可靶向蛋白”提供新的视角和方向。
2021年4月14日,中国科学院上海有机化学研究所生物与化学交叉研究中心朱继东课题组在Cell Research 上发表题为“
Pharmacological inhibition of SRC-1 phase separation suppresses YAP oncogenic transcription activity
”的文章,
提出了靶向转录激活因子SRC-1的相分离来抑制转录因子YAP致癌活性的药物开发策略。


Hippo/YAP信号通路在调控器官大小、组织再生及细胞命运决定中起关键作用
【10】
,YAP的异常活化与癌症的发生和转移密切相关
【11】
。在本次工作中,作者通过一系列生化实验发现SRC-1是YAP/TEAD转录复合物中的一个重要coactivator, 其可以通过上调YAP下游基因的H3K27ac来提升YAP转录活性。SRC-1蛋白本身带有两段PrD
(prion like domain)
, 可以发生液液相分离分布到YAP/TEAD 转录凝集物内,实验发现SRC-1/YAP/TEAD共定位的puncta内富集了包括H3K27ac和S5磷酸化的Pol II在内的活跃转录marke
r
(图1)
。
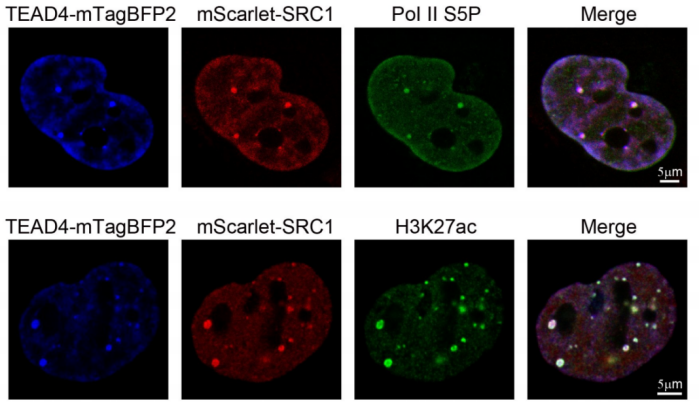
图1 H3K27ac和Pol II S5P富集在SRC-1/TEAD转录液滴里
此外,实验数据表明SRC-1在肺癌细胞的生长、增殖和迁移中扮演重要角色,肺癌病人的免疫组化数据显示SRC-1和YAP的表达量呈显著正相关。因此,开发调控SRC-1相分离的小分子化合物可以为抑制YAP转录活性提供新的思路。后续作者鉴定发现抗HIV药物
埃替格韦
(EVG/elvitagravir)
可以有效地抑制SRC-1的相分离
(图2)
,但不影响YAP/TEAD转录凝集物。进一步的验证表明,埃替格韦可以直接结合SRC-1蛋白,抑制YAP下游基因的表达及SRC-1和YAP介导的肿瘤细胞生长。

这一研究工作提出了一种基于液-液相分离的药理学策略,以“不可靶向”的SRC-1/YAP/TEAD转录复合物为靶点抑制YAP介导的肿瘤发生,体现了相分离作为一种新颖的方式来解决难成药靶点和以往难治愈疾病的优势和潜力。

图3 SRC-1与YAP/TEAD转录凝集物共分相促进YAP下游基因表达,埃替格韦通过抑制SRC-1的相分离来抑制YAP转录活性
值得一提的是,朱继东课题组于2020年10月1日在Cell上发表文章“
Phase separation of disease-associated SHP2 mutants underlies MAPK hyperactivation
”发现SHP2变构抑制剂ET070可以将SHP2锁定在“关闭”构象来抑制其相分离
【12】
,是小分子化合物抑制蛋白相分离的经典案例,这些结果都暗示相分离是可以被小分子药物靶向调控的
(详见BioArt报道:
。
中科院上海有机化学研究所生物与化学交叉研究中心的朱继东研究员为本文的通讯作者,
朱光亚
博士和
谢菁菁
博士为本文共同第一作者。上海奕拓医药科技有限责任公司参与本课题的研究。
https://www.nature.com/articles/s41422-021-00504-x
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。
1. Alberti, S., Gladfelter, A., and Mittag, T. (2019). Considerations and challenges in studying liquid-liquid phase separation and biomolecular condensates. Cell 176, 419-434.
2. Li, P., Banjade, S., Cheng, H.-C., Kim, S., Chen, B., Guo, L., Llaguno, M., Hollingsworth, J.V., King, D.S., and Banani, S.F. (2012). Phase transitions in the assembly of multivalent signalling proteins.
Nature
483, 336.
3. Su, X., Ditlev, J.A., Hui, E., Xing, W., Banjade, S., Okrut, J., King, D.S., Taunton, J., Rosen, M.K., and Vale, R.D. (2016). Phase separation of signaling molecules promotes T cell receptor signal transduction.
Science
352, 595-59
4. Alberti, S., and Dormann, D. (2019). Liquid–Liquid Phase Separation in Disease.
Annual Review of Genetics
53,3.1-3.24
5. Hofweber, M., Hutten, S., Bourgeois, B., Spreitzer, E., Niedner-Boblenz, A., Schifferer, M., Ruepp, M.D., Simons, M., Niessing, D., and Madl, T. (2018). Phase Separation of FUS Is Suppressed by Its Nuclear Import Receptor and Arginine Methylation.
Cell
173, 706-719.
6. Tulpule, A., Guan, J., Neel, D., Lin, P., Heslin, A., Allegakoen, H., Perati, S., Ramirez, D., Shi, X., Yang, B., Feng, S., Makhija, S., Brown, D., Huang, B., and Bivona, T. (2021). Kinase-Mediated RAS Signaling Via Membraneless Cytoplasmic Protein Granules.
Cell
184, 1-16
7. Boija, A., Klein, I., and Young. R.(2020) Biomolecular condensates and cancer.
Cancer Cell
, https://doi.org/10.1016/j.ccell.2020.12.003
8. Cai, D., Feliciano, D., Dong, P., Flores, E., Gruebele, M., Porat-Shliom, N., Sukenik, S., Liu,Z. and Lippincott-Schwartz, J. (2019) Phase separation of YAP reorganizes genome topology for long-term YAP target gene expression.
Nat. Cell Biol.
21, 1578-1589.
9. Zamudio, A., Dall’Agnese, A., Henninger, J., Manteiga, J., Afeyan, L., Hannett, N., Schuijers, J. and Young, R.(2019) Mediators condensates localize signaling factors to key cell identity genes.
Mol. Cell
76,1-14
10. Meng, Z., Moroishi, T. and Guan, K.-L. (2016) Mechanisms of Hippo Pathway Regulation.
Genes. Dev.
30, 1-17.
11. Harvey, K.F., Zhang, X. and Thomas, D.M. (2013) The Hippo pathway and human cancer.
Nat. Rev. Cancer
13, 246-257.
12. Zhu, G., Xie, J., Kong, W., Xie, J., Li, Y., Du, L., Zheng, Q., Sun, L., Guan, M., Li, H., Zhu, T., He, H., Liu, Z., Xia, X., Kan, C., Tao, Y., Shen, H., Li, D., Wang, S., Yu, Y., Yu, Z., Zhang, Z-Y, Liu, C., Zhu, J. (2020) Phase separation of disease-associated SHP2 mutants underlies MAPK hyperactivation.
Cell
183, 490-502.







 药选址
药选址





