2021年1月19日/医麦客新闻 eMedClub News/--今日,致力于开发新一代癌症治疗的细胞疗法公司Tessa Therapeutics宣布,欧洲药品管理局( EMA)已经授予其自体CD30 CAR-T细胞候选产品优先药物(PRIME)称号,用于治疗复发/难治性经典霍奇金淋巴瘤(r/r cHL)患者。
▲ 图片来源于:
Tessa Therapeutics
优先药物计划(Priority Medicines scheme ,PRIME)是由欧洲药品管理局(EMA)于2016年3月发起的一项计划,旨在加强支持尚未满足医疗需求的药物开发。通过该计划,EMA为药物开发人员提供了增强支持,包括早期互动和对话,以及为候选产品在欧洲的审批提供了加速的监管途径。
据悉,本次PRIME称号的获得是基于两项针对r/r cHL的I/II期临床试验良好临床数据,由贝勒(Baylor )医学院和北卡莱罗纳大学林贝格( Lineberger)综合癌症中心负责进行。
研究数据显示,在最高剂量队列中,约60%的患者肿瘤完全消失,没有其他CAR-T产品常见的严重毒性,该结果发表在期刊Journal of Clinical Oncology 上。
有效性方面:中位随访时间为533天,所有可评估的患者1年无进展生存期为36%,总生存期为94%。在32例接受氟达拉滨预处理的活动性疾病患者中,总缓解率(OR)为72%,其中完全缓解(CR)为59%(19/32)。此外,体内CAR-T细胞的扩增为剂量依赖性。
安全性方面:最常见的毒副作用是3级或更高级别的血液不良事件。在10例患者中(10/41)观察到细胞因子释放综合征(CRS),级别均为1级;未观察到神经毒性。
值得一提的是,Tessa的主要候选产品CD30 CAR-T已经处于后期临床开发阶段,用于治疗淋巴瘤。
2020年2月份,Tessa公司宣布CD30 CAR-T获得FDA授予的再生医学先进疗法(RMAT)资格,用于治疗复发或难治性CD30阳性的经典型霍奇金淋巴瘤(cHL)患者。
推荐阅读:
生物药创新技术大会(BPIT)即将于2021年3月25日-26日在上海拉开序幕,四大分会场,精彩纷呈(。点击“阅读原文”,立即报名!
CD30是位于激活的淋巴细胞上的一种膜蛋白受体,是肿瘤坏死因子受体超家族的一员,主要特异性的表达于霍奇金淋巴瘤及间变大细胞淋巴瘤细胞表面,是霍奇金淋巴瘤及间变大细胞淋巴瘤的肿瘤标记物。在众多候选靶点中脱颖而出,是目前淋巴瘤治疗中极具希望的靶点。
CD30的特异性表达使其具有了良好的成药性,针对CD30的单克隆抗体和抗体偶联药物已被广泛开发,
例如
靶向CD30的
抗体-药物偶联物(
ADC药物
)brentuximab vedotin(武田/Seattle Genetics)以及
PD-1抑制剂
Nivolumab(百时美施贵宝)和Pembrolizumab(默沙东),显著改变了cHL的治疗格局。
但是对于r/r HL及间变大细胞淋巴瘤患者,抗体药物易产生耐药性,CD30 CAR-T细胞疗法成为这类患者可以持续性治疗的最佳方案。
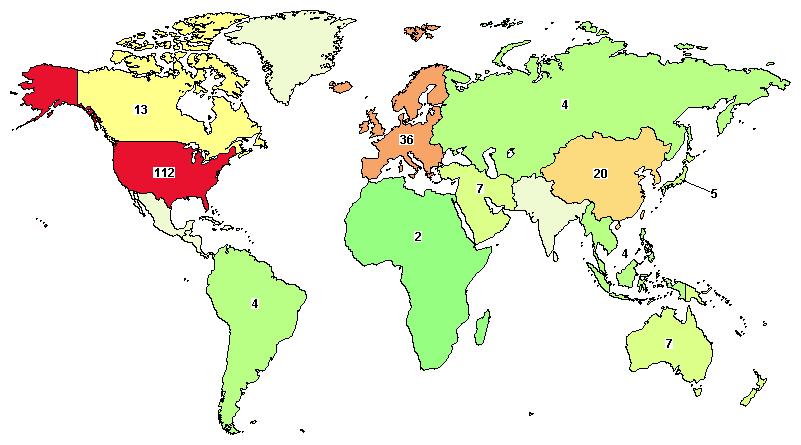
▲世界范围内靶向CD30的临床试验分布(图片来源:clinicaltrials.gov)
此外,越来越多的研究表明,CD30 CAR-T具有较低的毒性和脱靶效应,使得其作为HL潜在的治疗手段,从而被国内外多家公司/机构所重点关注。
目前,国内方面,优卡迪生物、武汉波睿达生物、宜明细胞等公司的CD30 CAR-T项目均获得国家知识产权局发明专利授权。其中武汉波睿达生物CD30 CAR-T的IND申请获国家药监局药品审评中心(CDE)受理(受理号: CXSL2000018)。该CAR-T产品也是国内申报临床的首个靶向CD30的自体CAR-T细胞疗法。
Tessa Therapeutics是一家临床阶段的生物技术公司,致力于开发下一代癌症细胞疗法的产品组合。Tessa拥有一系列基于CAR疗法的临床开发阶段产品管线,针对实体瘤和血液瘤。
▲Tessa公司产品管线(图片来源于:Tessa Therapeutics)
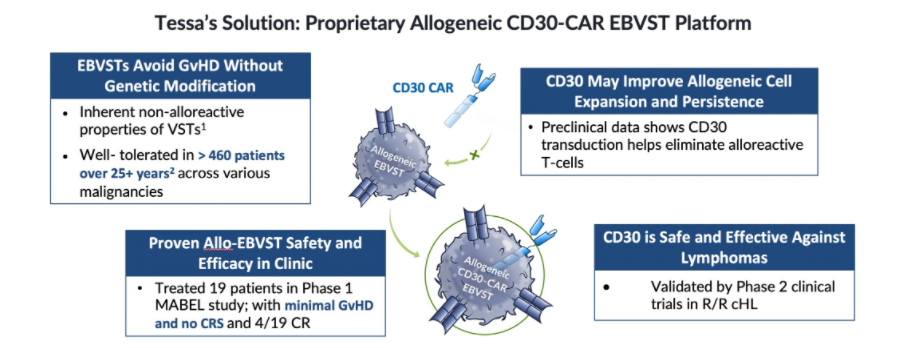
此前,Tessa Therapeutics公司研发部总裁Ivan D. Horak博士表示:“作为我们的长期研发项目的一部分,我们也正在开发一个同种异体CD30-CAR Epstein-Bar病毒特异性T细胞(CD30-CAR EBVST)治疗产品,它结合了VSTs和CAR的独特属性,旨在开发现成的细胞疗法用于治疗血液系统恶性肿瘤和实体瘤。”

▲ 图片来源于:Tessa Therapeutics
从健康个体获取的T细胞进行工程化,使其表达CAR,然后通过各种方法限制其对患者的免疫反应性。这种同种异体的CAR疗法能够长期储存,以便患者即时取用,节省CAR疗法的制备时间和提高制备成功率,提高产品可靠性,降低成本。
Tessa公司开发了一种VST疗法,VST是针对病毒感染而产生的高度特异性T细胞,这些细胞有能力识别和杀死受感染的细胞,同时激活免疫系统的其他部分,做出协调的反应。VSTs在体内持续存在,如果再次遇到病毒,就会激活快速的免疫反应。
迄今为止,
Tessa已在III期临床试验环境中成功制造并交付了150多种VSTs疗法
。
临床试验还证实,VSTs可应用于T细胞抗原受体(TCR)不删除或无其他基因修饰的同种异体环境,同时最大限度地降低移植排斥反应和其他与当前同种异体细胞治疗相关的严重反应的风险。
▲ 图片来源于:Tessa Therapeutics
与贝勒医学院合作,Tessa公司正在建立一个基于VST技术的同种异体平台,将CD30-CAR整合到VST上,并递送到
同种异体环境中
,以针对多种血液恶性肿瘤和实体肿瘤,同时应对自体CAR-T细胞的等待时间长,细胞材料可能缺乏的局限性。
▲图片来源于:Tessa Therapeutics
该技术的核心是通过CD30-CAR技术工程化Epstein Barr病毒(EBV,一种疱疹病毒)特异性T细胞(EBVSTs),增加VST细胞的持久性和扩增。目前正在和贝勒医学院合作进行该疗法的1期临床研究。
此外,为了克服CAR-T在实体瘤的局限性,Tessa公司将CAR-T细胞与二元溶瘤病毒疗法相结合。该疗法的步骤是,将溶瘤性和辅助依赖性腺病毒局部给药到肿瘤部位,然后全身输注CAR-T细胞。溶瘤病毒在局部杀死肿瘤细胞的同时改变肿瘤微环境,使得CAR-T细胞更容易浸润抵达肿瘤,以杀伤肿瘤细胞;辅助依赖性腺病毒将在局部刺激T细胞产生IL-12和PD-L1。
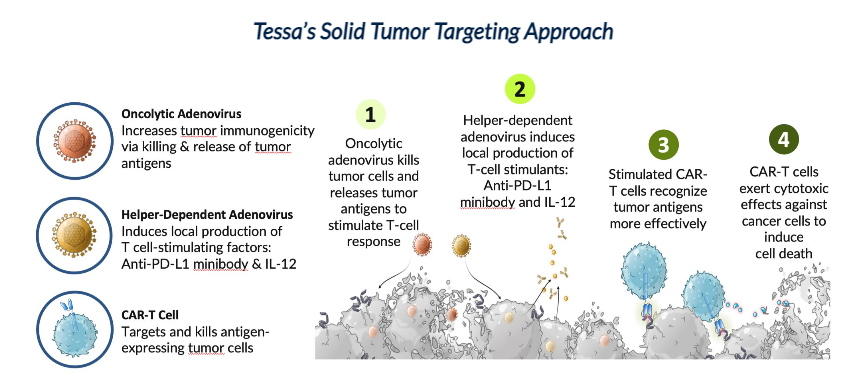
▲图片来源于:Tessa Therapeutics
Tessa公司正在和贝勒医学院合作,进行HER2 CAR-T和二元溶瘤病毒疗法相结合治疗实体瘤的1期临床研究。
事实上,近年来,肿瘤免疫疗法领域,联合疗法是一个热门的研究方向。越来越多的证据证明溶瘤病毒和CAR-T细胞具有协同作用的潜力,能够增强抗肿瘤效果。
推荐阅读:
目前,自体的CAR-T治疗已经取得了临床和商业的成功,更多靶点的开发是惠及更多患者并扩大其应用价值的重要策略之一。
同时,CAR细胞疗法在部分血液瘤上已经取得成功,但是在实体瘤和其他血液瘤上,还存在一定的挑战,开发出更多新型的治疗策略以攻克癌症是十分重要的。
我们期待这些领先的技
术更多的
转化成产品,为患
者提供更广泛的治疗选择。
参考资料:
1.https://www.biospace.com/article/releases/tessa-therapeutics-receives-prime-designation-from-european-medicines-agency-for-cd30-car-t-therapy/
2.https://www.tessacell.com/technology/#tech-allo

医麦客始终致力于生物创新药的前沿技术、行业动态、产业洞察等原创新闻报道,全媒体高端矩阵用户达16万+,其中工业用户占比超50%,科研与临床用户约为30%,投资机构用户超过5%。为促进产业细分领域的互动交流,我们组建了多个专业微信群,欢迎扫码加群。
 点击“阅读原文”,立即报名!
点击“阅读原文”,立即报名!












 点击“阅读原文”,立即报名!
点击“阅读原文”,立即报名!



 个人中心
个人中心
 我是园区
我是园区




