
点评 | Peng Ji(美国西北大学)、石莉红(中国医学科学院血液病医院)
红细胞对于机体正常生命活动至关重要,红系发育异常将导致红系相关疾病的发生,目前全球有超过一亿人患有红系紊乱性疾病,阐明红系发育调节机理,对于研究红细胞再生及防治相关疾病具有重要科学意义。
2023年3月17日
,中南大学生命科学学院分子生物学研究中心、血液学基础与应用湖南省重点实验室刘静教授课题组在Nucleic Acids Research发表了题为
The novel GATA1-interacting protein HES6 is an essential transcriptional cofactor for human erythropoiesis
的研究论文,发现了红系发育转录调控新机制。
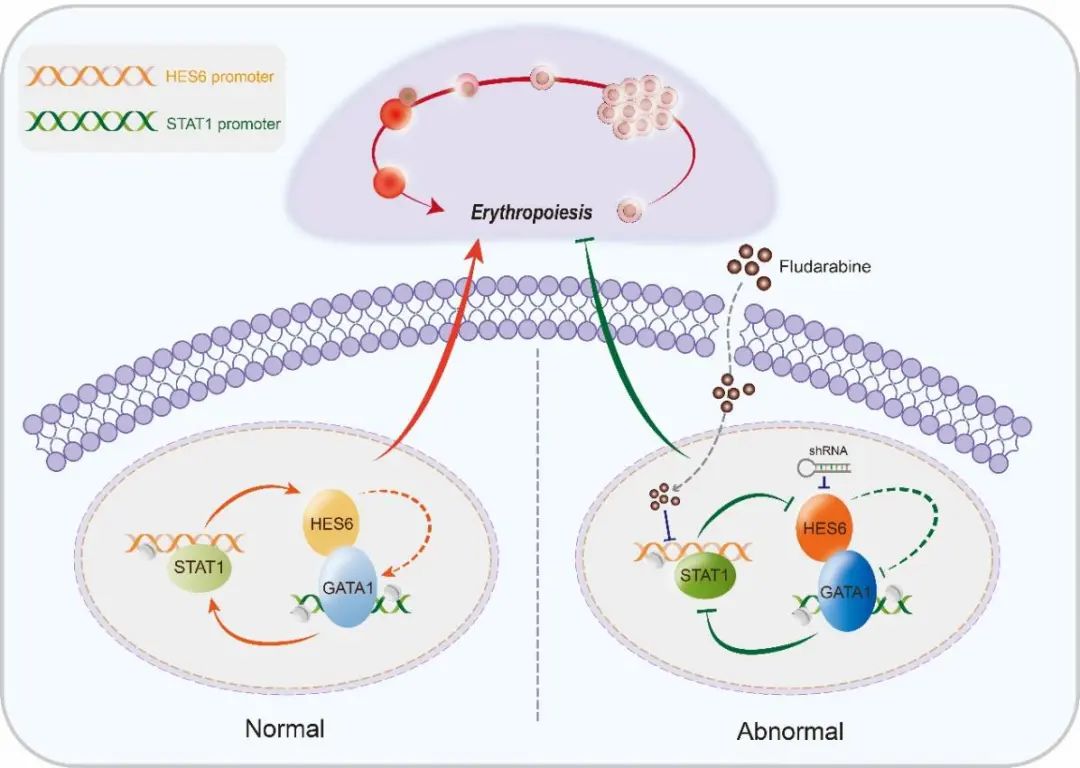
本文围绕红系中最重要的转录因子GATA1的调控开展了深入系统的研究。通过分析人红系发育转录组数据库发现,率先发现Basic Helix-Loop-Helix
(bHLH)
蛋白超家族成员HES6在红系分化进程中呈现表达明显增高,HES6能显著调控红细胞发育;利用Flag-HA pull down联合液相质谱、Co-IP及GST pull down等技术,证实HES6是GATA1的重要转录辅因子,并参与红系重要转录复合物GATA1-FOG1-NuRD;利用RNA-seq技术挖掘了HES6与GATA1的下游共调控靶基因;通过DNA pull down,ChIP-PCR与ChIP-seq等实验与生信分析技术,揭示HES6通过HES6-GATA1-STAT1组成的正反馈转录调控环路促进彼此表达水平。进一步,研究发现在红系分化进程中,促红细胞生成素
(
EPO
)
可促进该环路基因与蛋白表达,提示该环路是EPO/EPOR-JAK2信号下游一条重要响应通路;PV临床数据分析发现该环路在真性红细胞增多症
(
PV
)
中表达显著升高,敲低HES6与联用STAT1抑制剂Fludarabine可以更有效抑制PV来源红细胞的异常增殖;在PV小鼠模型中利用骨髓造血重建技术,证实抑制HES6表达水平可显著降低PV相关病理特征。
总之,
本研究提出HES6以GATA1重要转录辅因子身份影响红系增殖、分化、脱核等生理进程,并参与PV红细胞异常增殖,可作为体外高效扩增红细胞及PV治疗的潜在靶点。
中南大学生命科学学院刘静教授、王梓副教授及韩旭博士后为论文通讯作者,王梓副教授与博士研究生王攀为该论文的共同第一作者,中南大学湘雅医院、中南大学湘雅二医院、上海交通大学、湖南大学、美国纽约血液中心等多家单位合作参与了本研究。
刘静教授课题组长期致力于造血发育调控及肿瘤发生和治疗机制研究,在Blood、Proc Natl Acad Sci U S A、Adv Sci、J Exp Med.、J Immunother Cancer等期刊发表系列高研究论文,多篇入选ESI高被引论文及受到F1000论文推荐。课题组常年招收博士后,博士及硕士研究生,热诚欢迎有志之士加盟!
https://jinshuju.net/f/ZqXwZt
或扫描二维码
投递简历
红系发育是指多能造血干细胞在造血微环境中分化为成熟红细胞的动态过程,不同阶段特定基因的精确表达协调驱动正常红细胞的生成并维持机体正常生命活动,基因表达紊乱与多种血液疾病相关。解析红系谱系形成的机制,提高体外红细胞再生策略,是生命科技前沿的热点和难点,具有重要的科学意义。近年来已经从包括信号转导、表观遗传、代谢酶途径以及转录调控等多方面阐述红系发育调控,极大的丰富了红系发育调控分子机理。最近,刘静团队发现了红系分化中一个新的共转录因子HES6。功能研究发现敲低HES6抑制了人红系细胞的增值分化,机制研究阐明HES6通过与红系发育关键转录因子GATA1结合,调控其转录活性并与GATA1共同调节多个红系相关生物过程和途径基因的表达来促进红细胞生成。有趣的是,该团队发现GATA1通过转录调控STAT1间接调控HES6的表达,发现红系发育中HES6-GATA1-STAT1转录调控环路的存在。此外,HES6-GATA1-STAT1转录调控环路分子进一步被发现在PV(真性红细胞增多症)中高表达,并且敲低HES6抑制含JAK2V617F突变的PV病人细胞的生长并改善JAK2V617F小鼠的过度红细胞生成。该工作首次阐明红系发育中HES6的表达特点和功能机制,丰富了共转录因子在红系发育中的作用及调控机制。同时,该研究也引申出值得进一步深入探讨的有趣科学问题:Hes6在小鼠体内的功能机制?基于HES6结构设计特异性抑制剂治疗MPN(骨髓增生性肿瘤)是否可行?这些问题的解答将丰富我们对红系发育调控机制和疾病机理的认识,促进基础到临床的转化应用。
石莉红 中国医学科学院血液病医院
(中国医学科学院血液学研究所)
红细胞是机体内数量最多的血细胞,担负着输送氧气的重任。红细胞分化异常可导致各种各样的红系相关疾病,如不同类型贫血及红细胞增多症等。全球约有1/3的人口患有不同程度的红细胞疾病,严重影响患者的生命健康及生活质量。除了红细胞疾病外,体外生成红细胞也是再生医学领域的重大科学问题之一,其解决有助于缓解日趋严重的“血荒”危机。当前掣肘红细胞疾病发病机理认知、治疗策略开发及高效体外红细胞生产的主要因素是对红细胞发育分化调控机制缺乏系统、精准的理解。GATA1是红系调控的最重要转录因子之一,全面构建 GATA 1的精细调控网络对于指导红细胞发育分化具有重要意义。最近,中南大学刘静教授团队的研究发现了新型GATA1相互作用蛋白HES6并证实了其在红系发育中的关键作用。该研究揭示了HES6与GATA1相结合共调控系列红细胞分化重要基因的表达,形成了HES6-GATA1-STAT1正反馈转录调控环路。该环路也是响应促红细胞生成素EPO的重要渠道,参与促进红细胞生成。在真性红细胞增多症中,研究发现HES6参与了真性红细胞增多症中红细胞的异常增殖,而抑制HES6则可显著减缓PV小鼠的病理特征,提示 HES6有望成为治疗真性红细胞增多症的潜在靶点。总之,本研究通过对GATA 1转录调控网络的进一步剖析,发现了重要新成员HES6,并全面解析了该复合物在人类红细胞生成中的关键作用。不仅拓展了对红细胞发育分化机理的认知,为真性红细胞增多症的治疗提供了潜在靶点及新思路,还为体外生产红细胞提供了理论基础。在未来,随着红细胞发育分化调控网络的逐步完善,红细胞疾病的精准诊治及体外红细胞生产也将成为现实。
原文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkad167/7079638?login=true
制版人:十一
1. Liu J, Zhang J, Ginzburg Y, Li H, Xue F, De Franceschi L, Chasis JA, Mohandas N, An X. Quantitative analysis of murine terminal erythroid differentiation in vivo: novel method to study normal and disordered erythropoiesis. Blood. 2013,121(8): e43-49.
2. Li J, Hale J, Bhagia P, Xue F, Chen L, Jaffray J, Yan H, Lane J, Gallagher PG, Mohandas N, Liu J, An X. Isolation and transcriptome analyses of human erythroid progenitors: BFU-E and CFU-E. Blood. 2014, 124(24):3636-3645.
3. Han X, Zhang J, Peng Y, Peng M, Chen X, Chen H, Song J, Hu X, Ye M, Li J, Sankaran VG, Hillyer CD, Mohandas N, An X, Liu J. Unexpected role for p19INK4d in post-transcriptional regulation of GATA1 and modulation of human terminal erythroid differentiation. Blood. 2017,129(2):226-237.
4. Liang L, Peng Y, Zhang J, Zhang Y, Roy M, Han X, Xiao X, Sun S, Liu H, Nie L, Kuang Y, Zhu Z, Deng J, Xia Y,Sankaran VG, Hillyer CD, Mohandas N, Ye M, An X, Liu J. Deubiquitylase USP7 regulates human terminal erythroid differentiation by stabilizing GATA1. Haematologica. 2019,104(11):2178-2187.
5. Wang P, Wang Z,Liu J. Role of HDACs in normal and malignant hematopoiesis. Mol Cancer, 2020, 19(1):5.
6. Wang Z, Wang P, Li Y, Peng H, Zhu Y, Mohandas N, Liu J. Interplay between cofactors and transcription factors in hematopoiesis and hematological malignancies. Signal Transduct Target Ther. 2021 Jan 20;6(1):24.

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。














 个人中心
个人中心
 我是园区
我是园区





