近日,广州市妇女儿童医疗中心儿科研究所外科实验室贺静课题组在癌症生物学及生物化学领域权威期刊Biochimica et Biophysica Acta-Reviews on Cancer (IF:10.68,中科院一区)上发表了题为“The role of m6A modification in pediatric cancer”的综述。儿研所贺静副研究员和卓振建博士后为并列通讯作者,广州医科大学附属广州市妇女儿童医疗中心陈永平研究生、儿研所缪蕾副研究员和澳门科技大学林惠然博士生为共同第一作者。
以胶质瘤、肝母细胞瘤、肾母细胞瘤为代表的儿科癌症往往威胁着儿童健康,造成预后不良。近年来腺嘌呤N6位置的甲基化修饰(m6A修饰)着重于靶向治疗儿科癌症。
RNA中的m6A修饰通过表观遗传机制影响转录后的基因表达,从而决定了蛋白质的生物学功能,在癌症中发挥着举足轻重的作用。有关于m6A修饰对于儿科癌症的作用仍是值得探究,在研究中发现胶质瘤、肝母细胞瘤、肾母细胞瘤、神母细胞瘤、骨肉瘤、髓母细胞瘤、视网膜母细胞瘤和急性淋巴细胞白血病存在着m6A修饰现象,m6A修饰靶点可能成为推动儿科癌症治疗的关键。

m6A修饰过程
由于m6A修饰在信使RNA(mRNA)和非编码RNA(ncRNA)的表达过程中显著,所以可能存在多个儿科癌症的同一通路的m6A修饰现象,如促进骨肉瘤与视网膜母细胞瘤的同一通路PI3K/AKT的上游基因分别为WTAP与METTL3,它们是m6A修饰过程的重要因子。同时,研究还注意到除了单个m6A修饰因子调控儿科癌症的许多通路外,也会有多个m6A修饰因子(METTL3, METTL14, YTHDF2)通过TRIM7/BRMS1共同促进骨肉瘤的癌症发生。这些重要的因子有可能成为儿科癌症的潜在治疗靶点。
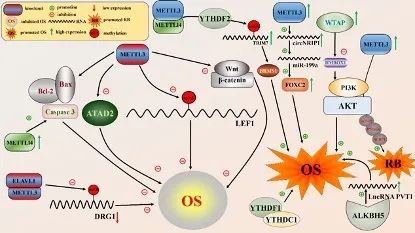
骨肉瘤与视网膜母细胞瘤的m6A修饰
然而,m6A修饰在儿科癌症中的作用仍处于初级阶段,其对儿科癌症的更多潜在机制、作用靶点仍是未知,这些都需要进一步的研究。相信未来势必浮现出更多的受到m6A调控的治疗靶点,以进一步解释m6A修饰如何发挥出对儿科癌症的决定性作用。
本项研究获得国家自然科学基金(82173593, 82002636, 82002635)以及广州市科学技术创新委员会基金(202102020421)的资助。
贺静团队主要工作聚焦在儿童肿瘤的分子流行病学及机制研究,其课题组近期发表了系列相关研究,包括:
1.发现BER通路FEN1基因rs174538多态性改变可显著降低神经细胞瘤发病风险(Cancer Communications,IF=10.392);
2.发现NER通路XPC基因具有作为肝母细胞瘤发病风险的生物标记物潜力(International Journal of Cancer,IF=7.396);
3.发现肿瘤相关巨噬细胞中的FABP4通过泛素化ATPB抑制NF-κB-IL1α通路,促进神经母细胞瘤进展(Clinical and Translational Medicine,IF=11.492)。
4.发表靶向RAS治疗神经母细胞瘤最新科学进展(Pharmacology & Therapeutics,IF=12.31)。
5.发表METTL14基因在肿瘤中的作用及机制最新科学进展(Journal of Hematology & Oncology,IF=17.388)。
广州市妇女儿童医疗中心贺静团队常年欢迎生命科学、统计学及医学类博士后、研究生等有志之士加入,共创未来。
有意向者可以发邮件至editor@bioon.com联系交流。
参考文献
1. Zhenjian Zhuo#, Chunlei Zhou#, Yuan Fang#, Jinhong Zhu, Hongting Lu, Haixia Zhou, Haiyan Wu, Yizhen Wang*, Jing He*: Correlation between the genetic variants of base excision repair (BER) pathway genes and neuroblastoma susceptibility in eastern Chinese children. Cancer Communications 2020, 40: 641-646.
2. Zhenjian Zhuo#, Miao Lei#, Wenfeng Hua#, Huitong Chen, Zhonghua Yang, Yong Li, Jiao Zhang, Suhong Li, Jiwen Cheng, Li Li, Huimin Xia, Jing He*: Genetic variations in nucleotide excision repair pathway genes and hepatoblastoma susceptibility. International Journal of Cancer 2021, 149(9):1649-1658.
3. Lei Miao#, Zhenjian Zhuo#, Jue Tang#, Xiaomei Huang, Jiabin Liu, Haiyun Wang, Huimin Xia*, Jing He*: FABP4 deactivates NF-κB-IL1α pathway by ubiquitinating ATPB in tumor-associated macrophages and promotes neuroblastoma progression. Clinical and Translational Medicine 2021, 11(4):e395.
4. Lei Lin#, Lei Miao#, Huiran Lin, Jiwen Cheng, Meng Li, Zhenjian Zhuo*, Jing He*: Targeting RAS in neuroblastoma: Is it possible? Pharmacology & Therapeutics 2021, 236:108054.
5. Qian Guan#, Huiran Lin#, Lei Miao#, Huiqin Guo, Yongping Chen, Zhenjian Zhuo*,Jing He*: Functions, mechanisms, and therapeutic implications of METTL14 in human cancer. Journal of Hematology & Oncology 2022, 15:13.
原文出处:
https://www.sciencedirect.com/science/article/abs/pii/S0304419X22000166?v=s5



 个人中心
个人中心
 我是园区
我是园区





