您还不是认证园区!
赶快前去认证园区吧!

11月9日,默沙东宣布,PD-1抑制剂帕博利珠单抗(可瑞达®️,K药)已获得中国国家药品监督管理局(NMPA)批准联合化疗新辅助治疗并在手术后继续帕博利珠单抗单药辅助治疗,用于经充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥20)的早期高危三阴性乳腺癌(TNBC)患者的治疗。
此次新适应证的获批是基于III期临床试验KEYNOTE-522的研究数据。
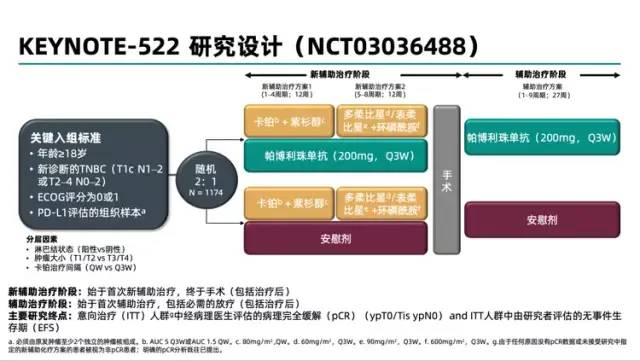
在第一次中期分析中,在首批接受随机化的602名患者中,帕博利珠单抗+化疗组 pCR 为64.8%(95%[CI],59.9-69.5),安慰剂+化疗组为51.2%(95%CI,44.1-58.3)。
经过15.5个月的中位随访(范围:2.7-25.0),帕博利珠单抗+化疗组7.4%的患者和安慰剂化疗组11.8% 的患者出现疾病进展,无法进行最终手术,局部或远处复发或第二原发肿瘤,或因任何原因死亡(HR=0.63;95%CI,0.43-0.93)。
在所有治疗阶段,3级或以上的治疗相关不良事件的发生率在帕博利珠单抗化疗组为78.0%,在安慰剂化疗组为73.0%,包括分别有0.4%(3名患者)和0.3%(1名患者)死亡。
此次帕博利珠单抗在华获批,开启了肿瘤免疫治疗在乳腺癌领域的全新征程,是国内首个获批治疗早期高危三阴性乳腺癌患者的肿瘤免疫治疗药物。
参考:https://www.nejm.org/doi/full/10.1056/NEJMoa1910549




 个人中心
个人中心
 我是园区
我是园区




