Nature背靠背 | 李佳智/王隆飞等揭示人tRNA 甲基化转移酶METTL1-WDR4工作的分子机制
收藏
关键词:
Nature揭示Nat
资讯来源:BioArt + 订阅账号
发布时间:
2023-01-05
随着表观遗传转录组
(Epitranscriptome)
学说的建立与发展,越来越多的研究发现RNA修饰在基因表达调控中起着至关重要的作用,进而影响着多种生物学进程。RNA修饰酶的突变或失调与癌症等疾病的发生过程有着十分密切的联系,这也成为了近年来的研究热点。RNA家族有超过170种的转录后化学修饰,而tRNA则是其中高度化修饰的一类, 这些修饰会影响其成熟,稳定和翻译等生物学功能
【1-3】
。N
7
-methylguanosine
(m7G)
是tRNA上最丰富的化学修饰之一,其甲基化转移酶METTL1-WDR4 复合物被证明与多种癌症等疾病的发生与调控具有相关性
【4-8】
。METTL1-WDR4 介导的m7G修饰也为癌症治疗提供了新的靶标,但是由于缺乏准确的结构信息,对于该修饰酶如何识别其底物以及其活性是如何被调控的分子机制还知之甚少,这也在很大程度上阻碍了针对其活性的小分子抑制剂药物的设计与研发。
2023年1月4日,哈佛大学医学院和波士顿儿童医院的Richard Gregory 课题组
(将入职内蒙古大学的
李佳智
博士和现任职武汉大学药学院的
王隆飞
教授为共同第一作者)
在Nature以研究文章
(Article)
的形式在线发表了题为
Structural basis of regulated m7G tRNA modification by METTL1–WDR4
的新进展。该研究首次获得了人源METTL1-WDR4复合物的晶体结构,并通过冷冻电镜解析了METTL1-WDR4与不同tRNA底物的复合物结构,包括METTL1-WDR4-tRNAPhe-SAH
(天然提取的酵母tRNAPhe)
和METTL1-WDR4-tRNAVal
(化学合成无修饰的人tRNAVal)
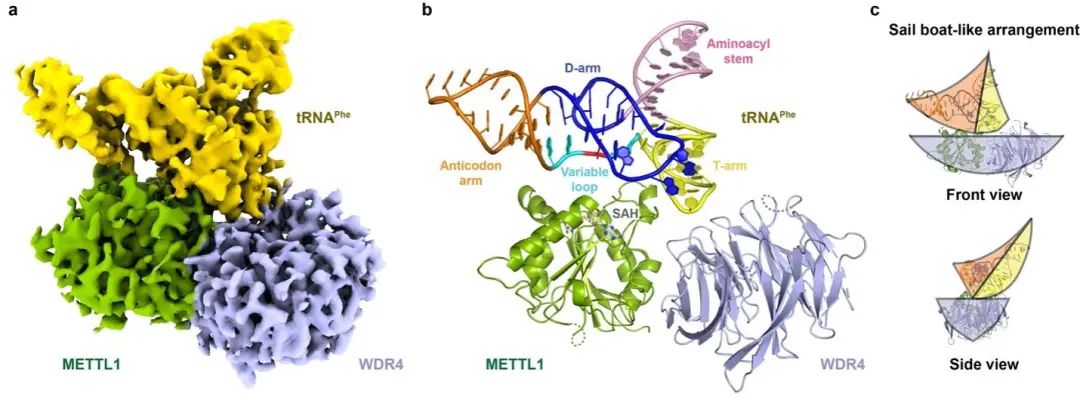
复合物的电镜结构。虽然两种底物tRNA的来源、序列及修饰状态不同,但METTL1-WDR4都采用了类似于“帆船”的整体结构结合tRNA底物
(图1)
。基于结构信息,并通过一系列生化,细胞及NMR等实验进行验证,
揭示了METTL1-WDR4识别底物tRNA的工作机制模型,并发现METTL1的N端参与活性口袋的构建,并通过磷酸化引发的空间位阻效应抑制其甲基化转移酶活性。
图1. METTL1-WDR4-tRNAPhe 的整体结构。
位于tRNA 第46位的m7G修饰
(G46位于tRNA 的Variable-loop domain)
是由METTL1和WDR4共同介导的,其中, METTL1是复合物中的活性单元,属于Class I 甲基化转移酶
(MTase)
家族成员之一;WDR4则是非活性单位,具有 WD蛋白家族经典的环状结构,由七个重复的结构域构成
(B1-B7)
。METTL1和WDR4形成二元复合物,为tRNA底物提供一个富集正电荷的结合平台。tRNA以倾斜的方式坐落于复合物上,使其修饰位点
(G46)
可以面向METTL1的活性口袋区域
(图1)
。WDR4则起到了脚手架
(scaffold)
的作用,通过其B3-B4结构域结合METTL1和tRNA 。这也解释了为什么METTL1需要结合WDR4 才能发挥其正常的甲基化转移酶活性。有趣的是,先前的研究报道了人WDR4的突变
(R170位点)
会诱发小头型原始侏儒症
【9,10】
。本文研究者发现R170正位于WDR4的B3-B4结构域相互作用界面,而该位点的突变会降低scaffold的稳定性,并影响METTL1的活性。这与报道的患者降低的tRNA m7G 修饰水平的结果一致,也为理解此类疾病致病机理及潜在的治疗提供了的理论基础。
作者还捕捉到了tRNA的局部解旋以及METTL1在结合tRNA底物时的构象变化,同时发现METTL1 通过其两个高度保守的helix结构域,抓住tRNA 的Variable-loop domain的两侧。在WDR4的辅助下,将待修饰的G46置于活性口袋区域,并达到识别底物的目的 。
研究报道发现,METTL1的第27位Serine 可以被AKT磷酸化修饰,而Ser27的磷酸化会导致METTL1失活
【11】
。Ser27位于METTL1的N端区域一段高度保守的序列中,有趣的是,在已解析的所有METTL1 或同源蛋白的晶体结构中都缺失该区域的结构信息。作者通过突变
(或截断)
实验,证明了N端的保守区域是METTL1正常发挥活性所必需的,但N端的作用以及磷酸化修饰调节其活性的工作机制尚不清楚。为了获取N端的整体印象,作者利用AlphaFold2对全长的METTL1-WDR4复合物进行了预测。Alphafold2对METTL1整体结构的预测具有相当高的可信度。预测结果显示METTL1的N端采用U-shaped 构象穿梭于活性口袋,而N端保守区域则参与了METTL1活性口袋的构建,并与电镜和NMR等实验结果非常一致。其中,Ser27位于活性口袋的中心,却未与重要的氨基酸残基形成相互作用。进一步的系列突变体实验发现
(Ser27突变为A,C,I,D,K,W等)
,Ser27突变为较长侧链的氨基酸时会降低METTL1的活性,而较短侧链的则不会。作者因此提出了METTL1通过Ser27磷酸化引发的空间位阻效应来抑制其甲基化转移酶活性的假说,并通过NMR滴定等实验对该假说进行了验证。
图3. 人METTL1-WDR4的工作及活性调节的模型。
与此同时,同期背靠背由UT southwestern Medical Center的Yunsun Nam 团队发表的题为
Structures and mechanisms of tRNA methylation by METTL1–WDR4
的研究论文,研究人员利用晶体学和冷冻电镜解析了METTL1, METTL1-WDR4 和METTL1-WDR4-tRNA等多个状态下的结构,并对催化活性中心进行了详细的探讨,揭示了除METTL1的N端外, WDR4的C端对METTL1发挥正常活性也十分重要。
总之,
两篇文章的整体结论一致又互补地对METTL1和WDR4修饰tRNA工作机制进行了更加完善的探索。由此为理解METTL1-WDR4介导的m7G修饰相关癌症等疾病的致病机理,和开发针对m7G修饰的抑制剂或药物提供METTL1-WDR4靶点的重要结构与机制信息,为新型治疗方法的开发奠定了重要基础。
https://doi.org/10.1038/s41586-022-05566-4
https://doi.org/10.1038/s41586-022-05565-5
1 Motorin, Y. & Helm, M. tRNA stabilization by modified nucleotides. Biochemistry 49, 4934-4944 (2010).
2 Pan, T. Modifications and functional genomics of human transfer RNA. Cell Res 28, 395-404, doi:10.1038/s41422-018-0013-y (2018).
3 Schimmel, P. The emerging complexity of the tRNA world: mammalian tRNAs beyond protein synthesis. Nat Rev Mol Cell Biol 19, 45-58, doi:10.1038/nrm.2017.77 (2018).
4 Orellana, E. A. et al. METTL1-mediated m(7)G modification of Arg-TCT tRNA drives oncogenic transformation. Mol Cell, doi:10.1016/j.molcel.2021.06.031 (2021).
5 Dai, Z. et al. N(7)-Methylguanosine tRNA modification enhances oncogenic mRNA translation and promotes intrahepatic cholangiocarcinoma progression. Mol Cell, doi:10.1016/j.molcel.2021.07.003 (2021).
6 Ma, J. et al. METTL1/WDR4-mediated m7G tRNA modifications and m7G codon usage promote mRNA translation and lung cancer progression. Molecular Therapy 29, 3422-3435 (2021).
7 Chen, J. et al. Aberrant translation regulated by METTL1/WDR4‐mediated tRNA N7‐methylguanosine modification drives head and neck squamous cell carcinoma progression. Cancer Communications 42, 223-244 (2022).
8 Han, H. et al. N7-methylguanosine tRNA modification promotes esophageal squamous cell carcinoma tumorigenesis via the RPTOR/ULK1/autophagy axis. Nature communications 13, 1-15 (2022).
9 Shaheen, R. et al. Mutation in WDR4 impairs tRNA m(7)G46 methylation and causes a distinct form of microcephalic primordial dwarfism. Genome Biol 16, 210, doi:10.1186/s13059-015-0779-x (2015).
10 Trimouille, A. et al. Further delineation of the phenotype caused by biallelic variants in the WDR4 gene. Clin Genet 93, 374-377, doi:10.1111/cge.13074 (2018).
11 Cartlidge, R. A. et al. The tRNA methylase METTL1 is phosphorylated and inactivated by PKB and RSK in vitro and in cells. The EMBO journal 24, 1696-1705 (2005).

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。










 药选址
药选址









