
点评 | 施国平(哈佛大学医学院)、魏园园(复旦大学)、胡德胜(华中科技大学)
长期以来,心脑血管疾病是导致的我国居民死亡的头号杀手,动脉粥样硬化是一种老年慢性血管疾病,其导致血管狭窄、堵塞、诱发中风和心梗是心脑血管疾病主要的发病机制之一。T细胞在机体免疫系统中扮演重要的作用,并在体内受到各种免疫检查点的严格调控。大家都知道T细胞对动脉粥样硬化疾病的进展很重要,然而对于T细胞免疫检查点的受损是不是疾病驱动因素之一尚不清楚。
2023年2月23日,中山大学附属第一医院尹长军教授团队与德国慕尼黑大学Andreas Habenicht教授团队以研究长文形式在Nature Cardiovascular Research上发表文章Pairing of single-cell RNA analysis and T cell antigen receptor profiling indicates breakdown of T cell tolerance checkpoints in atherosclerosis。他们研究发现外周组织区域特异性、细胞亚型特异性的T细胞外周免疫检查点受损可能是驱动动脉粥样硬化疾病进展的关键。这是该团队继2019年发表Nature Medicine之后又一篇关于动脉粥样硬化的工作。

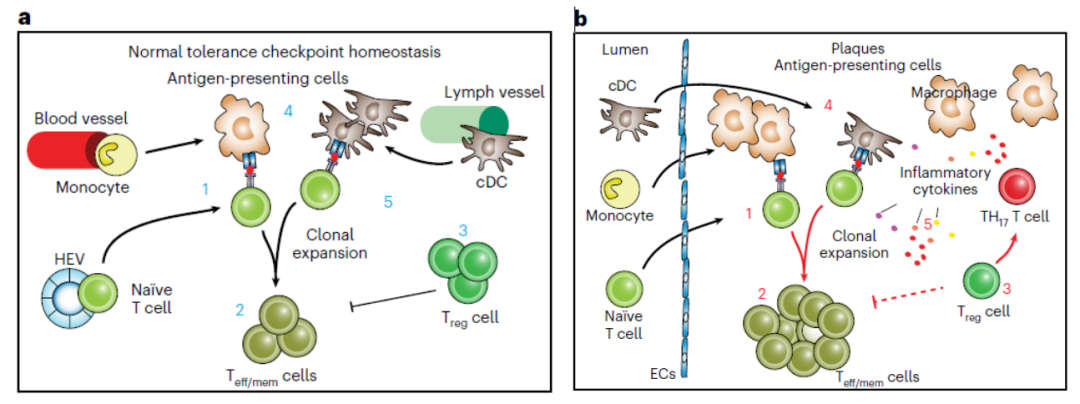
该合作团队利用老年疾病小鼠模型对上述问题做了系统性的研究,通过对比研究动脉粥样硬化斑块内部,疾病血管外膜第三级淋巴器官,疾病小鼠血管周围第二级淋巴器官,以及正常小鼠血管周围淋巴器官,发现多个T细胞免疫检查点的受损存在组织特异性以及细胞特异性。其中动脉粥样硬化斑块内部所有检查的T细胞免疫检查点均处于受损的状态,而疾病相关第三级淋巴器官中受损情况次之,疾病相关第二级淋巴器官再次之,血液和健康小鼠的第二级淋巴器官极少或者并无受损。另外,T细胞免疫检查点受损状态也与T细胞亚型有关,比如调节性T细胞在斑块内失去调节功能,并从好细胞往坏细胞转变。伴随斑块内T细胞免疫检查点受损,斑块内免疫细胞处于活化状态,并出现T细胞异常高水平增殖。团队进一步分析前人动脉粥样硬化疾病的单细胞数据情况,发现在人冠状动脉粥样硬化斑块和颈动脉斑块中也存在类似的CD8 T细胞免疫检查点受损的情况。
基于以上发现,该国际合作团队提出:在动脉粥样硬化斑块内免疫微环境下,存在多个T细胞外周免疫检查点受损的现象,而这可能是驱动动脉粥样硬化疾病进展的关键因素。基于上述科学假说,该团队提出多个可能的新治疗策略来治疗该疾病,比如阻止斑块内Treg细胞功能性失活策略、基于斑块内异常增殖的T细胞的数据,鉴定疾病相关自身抗原,从而设计动脉粥样硬化T细胞疫苗防治该疾病等。
该研究由王志华博士、张溪博士生,陆树博士生担任共同第一作者,Andreas Habenicht教授和尹长军教授担任共同通讯作者。
尹长军,国家级青年人才项目获得者,研究员,博士研究生导师。2013年于德国耶拿·弗里德里希·席勒大学获得博士学位。2014-2018期间于德国慕尼黑大学医学院接受博士后训练。2018-2022期间担任德国慕尼黑大学医学院心血管预防研究所课题组组长,期间基于其研究工作提出了治疗动脉粥样硬化和阿尔茨海默病的新策略,获得2019年拜耳血栓研究奖。经中山大学“百人计划”项目引进,2022年3月全职入职中山大学附属第一医院精准医学研究院。长期从事动脉粥样硬化和阿尔茨海默病等慢性疾病免疫损伤机制研究,代表性论文发表在Nature Medicine、Nature Cardiovascular Research、Circulation Research、ATVB等知名期。课题组招收博士后2-3名,待遇丰厚,欢迎对科学研究有浓厚兴趣的同学加入。详情参见:
http://gzsums.net/custom-52/info-1189-28005.aspx
施国平(哈佛大学医学院,哈佛医学院附属Brigham妇女医院,麻省理工学院/哈佛大学附属Broad研究所)
2017年,我同事兼朋友Peter Libby和Paul Ridker教授(哈佛大学医学院)发起并领导的CANTOS临床试验为炎症在动脉粥样硬化中的作用提供最直接的临床证据 (Ridker et al., 2017)。该研究不仅仅平息了动脉粥样硬化是否被认为是一种慢性炎症疾病长期以来的争论,更让动脉粥样硬化炎症反应研究领域进入到一个全新的阶段。T细胞是一种重要的免疫细胞,其在动脉粥样硬化疾病中的作用一直受到大家的重视。多年来的研究已经发现多种T细胞亚型参与动脉粥样硬化疾病进展,并在其中扮演不同的角色,比如促炎的CD8 T细胞,抗炎的调节性T细胞(Treg),或者功能具有多样性的CD4 T细胞。然而该研究领域内两个核心问题还有待进一步的研究:第一个核心问题是,在动脉粥样硬化疾病发生发展过程中,疾病特异性的T细胞反应是发生在哪个组织?是在淋巴结或脾脏?还是在动脉粥样硬化斑块内部?第二个核心问题是,动脉粥样硬化疾病进展是否伴随着能够针对血管自身抗原的自身免疫T细胞的产生?以及这些自身免疫T细胞反应是否影响疾病进展?第二个问题尤其的重要,因为对该问题的研究,能够让我们弄清楚动脉粥样硬化这个疾病是否能作为一种自身免疫性疾病来对待,阐明这个问题预计会为该疾病的治疗带来革命性和策略性的改变。然而,就像在其他临床上重大慢性自身炎症疾病的研究中遇到的困难一样,寻找疾病特异性自身抗原的研究进展非常缓慢。随着近几年单细胞测序 (scRNA-seq)、单细胞T细胞受体测序(scTCR-seq)等新技术的不断更新换代,大家似乎看到了解决上述难题的一些希望。
在该研究中,Wang et al.,利用高通量scRNA-seq结合scTCR-seq技术,对老年ApoE敲除小鼠(具有较成熟的动脉粥样硬化斑块病理)中可能参与动脉粥样硬化疾病进展的多种组织构建了单细胞免疫图谱和单细胞TCR组库,包括了动脉粥样硬化斑块组织,动脉第三极淋巴组织(ATLOs),淋巴结,和血。该研究团队发现,在动脉粥样硬化疾病中,多种T细胞亚型发生了组织特异性的异常克隆性增殖,包括Treg细胞,CD4 T细胞,以及CD8 T细胞。其中动脉粥样硬化内T细胞克隆增殖程度最高,紧接着是血管外膜有炎症的第三极淋巴器官,其次是淋巴结组织,而健康老年对照小鼠的淋巴组织或血液内很低,这些结果提示不同组织内存在不同程度的T细胞耐受机制受损。进一步分析多种T细胞耐受机制在这些组织中受损情况,比如控制naive T细胞活化的机制,控制效应性T细胞杀伤功能的机制,调节性T细胞调控机制,抗原提呈细胞的机制等均存在类似的组织特异性受损的情况。因此,该研究团队提出组织区域性、细胞亚型特异性的T细胞免疫耐受机制受损可能是动脉粥样硬化疾病驱动因素之一。这些数据为将来进一步鉴定动脉粥样硬化疾病特异性T细胞自身抗原规划了一个蓝图,并有望开发和利用CAR-T细胞直接靶向病变血管的T细胞疗法提供支持。
魏园园(复旦大学基础医学院,青年研究员)
动脉粥样硬化是由高血脂症引发的慢性血管炎症,是导致严重心血管疾病(例如冠心病和心肌梗塞)的主要原因之一。虽然经过降脂治疗,不良心血管事件的发生率可降低50%,但是炎症的存在仍旧是主要的风险因素。长期以来,关于动脉粥样硬化的炎症研究聚焦在固有免疫细胞,特别是针对巨噬细胞及其分泌的细胞因子。CANTOS临床试验表明,使用白介素-1β单克隆抗体 Canakinumab后,主要心血管事件的发病风险可降低15% (Ridker et al., 2017),提示炎症在动脉粥样硬化发病过程中的关键作用。
另外,研究发现,特异性识别ApoB抗原肽的调节性T细胞在动脉粥样硬化中发生了功能失调及病理性转换,进一步佐证了该理论:动脉粥样硬化是伴随着自身免疫反应的慢性炎症疾病 (Saigusa et al., 2020)。这一理论模型提出的同时也带来很多问题:诱导斑块内自身免疫反应的自身抗原是什么?有哪些适应性免疫细胞亚群参与了动脉粥样硬化的自身免疫反应?这些免疫细胞是如何打破免疫耐受后活化进而产生慢性炎症的?这些问题的解决有助于进一步推进靶向炎症的动脉粥样硬化临床治疗方案。
尹长军博士团队通过单细胞RNA测序联合T细胞受体测序技术,绘制了罹患动脉粥样硬化的老年小鼠内斑块、血管外膜三级淋巴器官(ATLOs)以及主动脉旁肾淋巴结(RLNs)中的免疫细胞图谱。首先,作者发现,在老年Apoe缺失小鼠的动脉粥样硬化斑块、ATLOs和RLNs中, CD4+ T细胞、调节性T细胞和CD8+ T细胞均有不同程度的克隆性增殖。相比于淋巴结,斑块内的CD4+ naïve T细胞上调表达活化、增殖和迁移相关的基因,提示其静息状态可能被破坏;而效应和记忆CD4+/CD8+ T细胞的转录谱在老年Apoe缺失小鼠中亦发生了组织特异性的改变。
作者进一步的分析表明,斑块内的调节性T细胞下调表达Foxp3,并上调表达Th17细胞相关基因(Il17a, Rora, Rorc);作者发现了2个表达相同TCRαβ链的T细胞,一个是在淋巴结中的Foxp3+Rorc- T细胞,另一个是在斑块内的Foxp3+Rorc+ T细胞,这2个来自同一个克隆的T细胞走向不同的命运,进一步为斑块内调节性T细胞向Th17细胞的转换提供了佐证。除此之外,相比于ATLOs和RLNs,来自于同一个克隆的T细胞在斑块内表现出了特异性的基因表达模式,提示斑块微环境重塑了T细胞的基因表达谱。
基于耐受性CD11c-树突状细胞和Trem2hi巨噬细胞中共刺激/共抑制分子表达的上调,作者认为抗原呈递细胞的功能失常也可能是T细胞免疫耐受被打破的原因之一。
最后,作者通过整合分析公共数据库中的人动脉粥样硬化斑块的单细胞RNA测序数据,发现CD8+ T细胞在人的斑块内发生了与小鼠斑块内类似的转录谱改变,提示人动脉粥样硬化斑块内CD8+ T细胞免疫耐受的损伤。
尹长军博士团队的这项研究表明,动脉粥样硬化斑块内T细胞的外周免疫耐受被打破,为“动脉粥样硬化自身免疫学说”提供了有力的证据。该项研究揭示了参与动脉粥样硬化自身免疫反应的T细胞亚群及可能的机制,并在转录组层面为靶向炎症的动脉粥样硬化治疗策略提供了坚实的研究基础。
胡德胜(华中科技大学协和医院,教授)
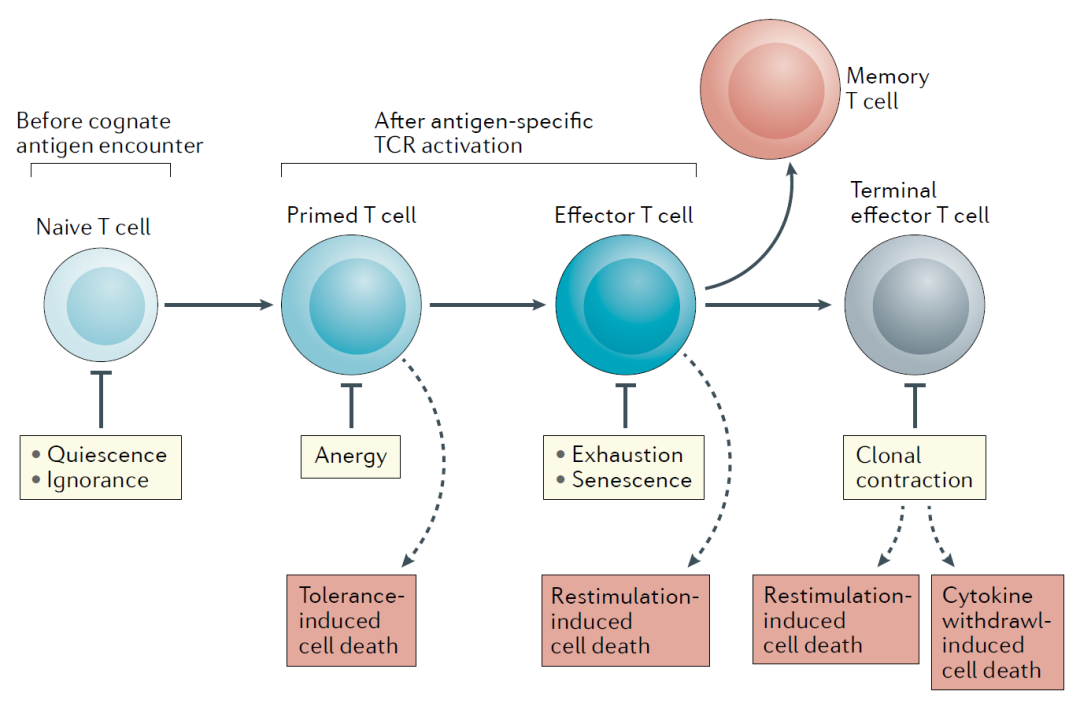
T细胞在机体免疫系统中扮演重要的作用。成熟的T细胞从胸腺迁出后即开始了它的保家卫国的戎马一生,它既要执行重要的效应功能,又需要确保自身组织免受攻击,T细胞介导的免疫反应需要被严格控制,即“T细胞耐受(T cell tolerance)”。T细胞的“中心耐受”指的是其胸腺发育阶段的阴性和阳性选择,而“外周耐受”值得只迁出胸腺的T细胞所经历的负向调节机制。2020年发表于Nature Review的一篇观点文章总结了T细胞在外周所要经历的6道负向调节关卡/检查点(checkpoints)【注:此checkpoint不是指PD-(L)1,CTLA-4,TIGIT等免疫检查点分子】,包括静息quiescence, 忽视ignorance, 失能anergy, 耗竭exhaustion, 衰老senescence 和死亡death。在naïve T细胞阶段,“静息”和“忽视”是维持T细胞耐受的主要机;T细胞活化是缺失共刺激分子则会发生“失能”;而当T细胞被成功激活抵达效应阶段,“耗竭”和“衰老”则是限制T细胞过度活化的主要机制 (ElTanbouly, 2021)。
长期以来,心脑血管疾病是导致的我国居民死亡的头号杀手,动脉粥样硬化是一种老年慢性血管疾病,是心脑血管疾病主要的发病机制之一。同时越来越多的报道证实了CD8+T细胞,CD4+T细胞及Treg细胞在动脉粥样硬化中的重要作用。一个重要的问题是动脉粥样硬化中是否存在抗原特异性的自身免疫T细胞呢?实际上,早在1995年美国科学院院刊就报道了瑞典Hansson教授团队关于人动脉粥样斑块中的T细胞可以识别氧化的低密度脂蛋白(Stemme, 1995)。另外,奥地利的Wick教授团队发现人的HSP 60亦被认为与病原菌来源的HSP60蛋白有交叉反应性而可能是潜在的自身抗原(Wick, 1999)。最新单细胞转录组测序数据在人斑块里鉴定到了APOB特异的CD4+T细胞 (Saigusa, 2022) 和斑块特异的效应CD4+T细胞扩增(Depuydt, 2023)。以上证据均提示动脉粥样硬化具有自身免疫病的特征。与此呼应的是,动脉粥样硬化中B细胞的研究也鉴定出大量自身免疫的B细胞克隆 (Sage 2019)。此外,多项研究报道了在自身免疫性疾病中动脉粥样硬化加重的现象。综上所述,这些斑块特异的T细胞克隆是如何突破“外周耐受”的限制获得致病性的呢?
近日,中山大学附属第一医院尹长军教授领导的国际合作团队在Nature Cardiovascular Research以研究长文形式发表了其研究成果 (Wang, 2023)。该研究团队通过采用单细胞RNA测序和单细胞TCR测序系统性的研究了动脉粥样硬化不同组织,不同T细胞亚型的免疫耐受变化。其结果显示动脉粥样硬化疾病中存在广泛的T细胞免疫耐受失调,并以动脉粥样硬化斑块最为明显,并涉及多种细胞类型,例如CD4/CD8,幼稚T细胞,免疫调节性Treg细胞,CD4/CD8 效应记忆T细胞,抗原提呈细胞等。这项研究全面揭示了小鼠晚期动脉粥样硬化斑块微环境中T细胞外周耐受性破坏的潜在机制,为未来对T细胞耐受检查点的研究和对动脉粥样硬化发病机制的认识提供了重要的线索和宝贵的工具。
制版人:十一
参考文献
1. Depuydt, M. C. et al. Single-cell T cell receptor sequencing of paired human atherosclerotic plaques and blood reveals autoimmune-like features of expanded effector T cells. Nature cardiovascular research. 2023.
2. ElTanbouly, M. A. et al. Rethinking peripheral T cell tolerance: checkpoints across a T cell's journey. Nature Reviews Immunology. 2021, 21, 257-267.
3. Ridker PM, Everett BM, Thuren T, MacFadyen JG, Chang WH, Ballantyne C, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med. 2017;377(12):1119-31.
4. Sage AP, et al. The role of B cells in atherosclerosis. Nature Reviews Cardiology, 2019, 16, 180-196.
5. Saigusa, R., H. Winkels, and K. Ley. 2020. T cell subsets and functions in atherosclerosis. Nat Rev Cardiol, 2020, 17:387-401.
6. Saigusa, R. et al. Single cell transcriptomics and TCR reconstruction reveal CD4 T cell response to MHC-II-restricted APOB epitope in human cardiovascular disease. Nature cardiovascular research, 2022, 1, 462-475.
7. Stemme, S. et al. T lymphocytes from human atherosclerotic plaques recognize oxidized low density lipoprotein. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92, 3893-3897.
8. Wang Z, Zhang X, Lu S, Zhang C, Ma Z, Su R, et al., Pairing of single-cell RNA analysis and T-cell receptor profiling indicates breakdown of T-cell tolerance checkpoints in atherosclerosis. Nature Cardiovascular Research. 2023; xxxxxxxx
9. Wick, G. & Xu, Q. Atherosclerosis--an autoimmune disease. Experimental gerontology, 1999, 34, 559-566.




转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区





