
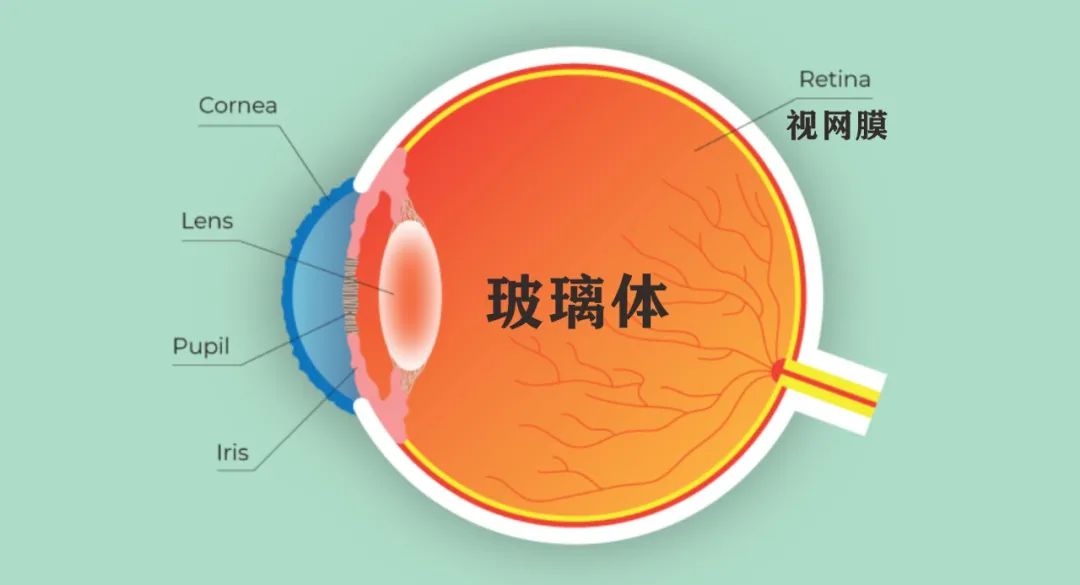
导致视力迅速下降的基因突变的发生率比我们通常认为的更高,全世界约有五百万人患有先天性视网膜营养不良,这通常会在幼年时期就导致失明。这些疾病往往是由特定的基因突变导致,目前已经发现了大约150个此类基因突变,这些突变会导致感光细胞或形成视网膜色素上皮的细胞功能丧失,从而导致失明。
之前,这种先天性失明一直无药可医,直到2017年12月10日,FDA批准了Spark公司的AAV基因疗法,通过腺相关病毒(AAV)载体,将正确的RPE65基因递送到视网膜细胞,用于治疗先天性黑蒙症2型。这也标志着人类基因治疗时代的正式到来。
但迄今为止,基于AAV病毒载体的眼病基因治疗,都需要将病毒载体直接注射到视网膜下,这种技术只有在拥有高水平专家和设备的专科医院才能进行,并且这种注射方式存在损坏脆弱的视网膜组织的风险。该方法的另一个缺点是由于AAV病毒横向扩散能力较弱,每次注射只能靶向注射点附近的一小部分细胞。
因此,需要开发出更好的适用于眼病基因治疗的病毒载体,可以通过微创给药就能更有效靶向视网膜感光细胞,以更安全更高效地治疗遗传性失明。
近日,德国慕尼黑大学等单位的研究人员在 EMBO Molecular Medicine 杂志发表了题为:Novel AAV capsids for intravitreal gene therapy of photoreceptor disorders 的研究论文。
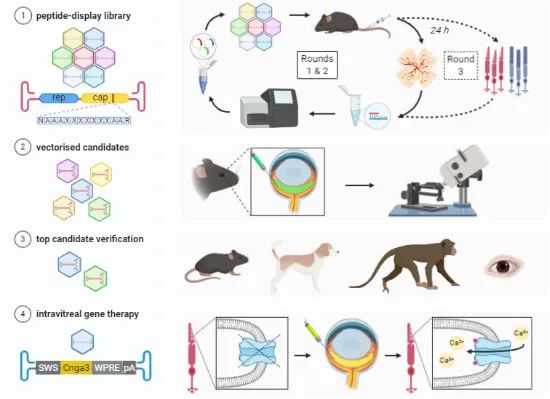
研究团队开发了两种优化的新型腺相关病毒(AAV)载体——AAV2.GL和AAV2.NN,在小鼠、狗和猴子这三种动物模型眼睛中的实验显示,这两种新型AAV载体只需简单注射到眼睛的玻璃体内即可高效靶向视网膜感光细胞。同样也能高效转导人视网膜外植体培养的感光细胞。



扫码登记信息,即可领取下载地址!
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。




 个人中心
个人中心
 我是园区
我是园区




