
2021年6月29日,上海交通大学医学院基础医学院的侯照远研究员,贾浩副研究员和上海交通大学医学院附属同仁医院彭海霞主任合作(上海交通大学医学院基础医学院贾浩副研究员,杨于权硕士和李梦莹博士为该论文的共同第一作者)在EMBO Reports在线发表了Snail enhances arginine synthesis by inhibiting ubiquitination-mediated degradation of ASS1 论文。该研究首次揭示了泛素化修饰参与调控精氨酸合成和尿素循环, 转录因子Snail能抑制精氨酸琥珀酸合成酶1(ASS1)的泛素化降解,增强结直肠癌细胞内精氨酸的合成,从而促进肿瘤细胞迁移。
转录因子Snail属于含有SNAG结构域的锌指(zinc-finger)蛋白家族成员,是诱导上皮-间质细胞转换(EMT)和肿瘤细胞转移关键因子。该团队一直致力于探究Snail促进肿瘤转移的分子机制,取得了一系列发现:Snail通过SNAG 结合Ajuba和精氨酸甲基化酶Prmt5(MCB 2008,Cancer Research 2010, Developmental Cell 2010),通过锌指结构域招募泛素化酶Ring1A/B(Cancer Research 2014)对其靶染色质的组蛋白进行甲基化和单泛素化修饰而实现基因的转录抑制调控;Snail诱导的硫酸化修饰通路对维持乳腺癌细胞间质细胞表型和转移至关重要(Cell Death & Differ. 2019);去泛素化酶USP29 协同去磷酸化酶SCP1稳定Snail蛋白(Oncogene 2020)。
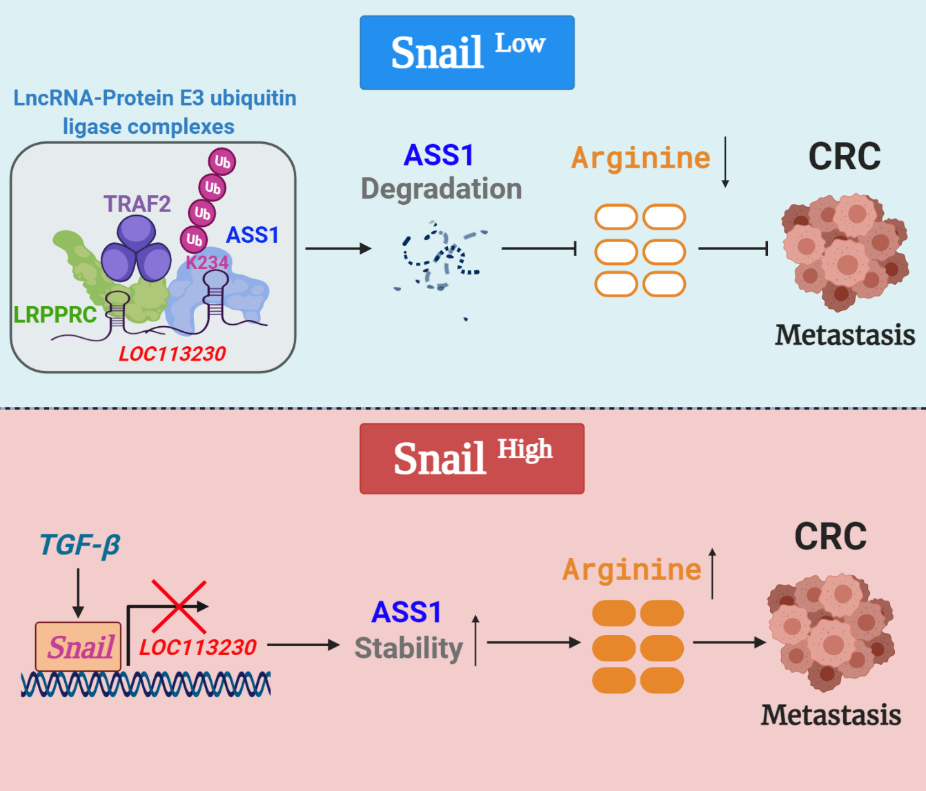
在此基础上,该团队最新发现了Snail促进结直肠癌转移的新机制。在高表达Snail的结直肠癌样本中,ASS1的泛素化降解被抑制,细胞内的精氨酸合成明显增加。ASS1是催化精氨酸生物合成途径的倒数第二步,并与精氨酸琥珀酸溶解酶(ASL)一起利用天冬氨酸,瓜氨酸和ATP合成精氨酸。目前报道的ASS1在不同肿瘤中功能具有两面性,研究发现在黑色素瘤,肝细胞癌,间皮瘤,肾细胞癌和前列腺癌等肿瘤中由于ASS1表达的缺失表现出精氨酸营养缺陷性特征。相反,在结直肠癌,卵巢癌和胃癌等,由于这些癌细胞具有较高的ASS1活性并可以产生精氨酸,这些肿瘤的恶性进展并不依赖于外源性精氨酸,这也说明了ASS1可能是治疗这些癌症的重要靶标。
本研究还有一个重要的发现就是参与降解ASS1的E3泛素化复合体中包含一个长链非编码RNA(LOC113230), 该非编码RNA作为支架将E3连接酶 TRAF2和LPRRPC组装起来,招募到ASS1 K234位点进行泛素化修饰。在高表达Snail的结直肠癌细胞中,Snail通过结合到LOC113230启动子E-BOX区域抑制了该RNA的转录,导致了E3泛素化复合体无法装配,从而抑制了ASS1的泛素化降解。
原文链接
https://www.embopress.org/doi/abs/10.15252/embr.202051780
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




