Alnylam Pharmaceuticals公司近日宣布,其在研RNAi疗法vutrisiran,在治疗遗传性转甲状腺素蛋白(hATTR)淀粉样变性患者的3期临床试验中达到9个月后的主要终点和两个次要终点。该公司计划在今年年初向美国FDA递交新药申请(NDA),如果获得批准,将成为Alnylam获得FDA批准的第四款RNAi疗法。

遗传性转甲状腺素蛋白(hATTR)淀粉样变性是一种因为TTR基因突变引起的遗传性、进行性疾病,通常具有致死性。TTR基因突变导致异常淀粉样蛋白蓄积并损伤身体器官和组织,如外周神经和心脏,导致顽固性外周感觉-运动神经病变、自主神经病变和/或心肌病,以及其他疾病表现。hATTR淀粉样变性代表了重大未满足的医疗需求,发病率和死亡率显著,全球约有50,000人受累。诊断后的中位生存期为4.7年,心肌病患者的生存期只有3.4年。
Vutrisiran是一款在研皮下给药的RNAi疗法,它能够靶向和沉默特定mRNA,从而阻断野生型和突变体转甲状腺素蛋白的产生,延缓疾病进展。Alnylam在2018年首款获得FDA批准的RNAi疗法Onpattro就是治疗hATTR淀粉样变性的一款RNAi疗法,然而那款疗法需要每隔3周通过静脉注射给药。Vutrisiran利用了Alnylam的增强稳定化学(ESC)-GalNAc-偶联递送平台,提高了它的效力和代谢稳定性,让患者只需每3个月接受一次皮下注射治疗。

▲Onpattro与vutrisiran简介(图片来源:参考资料[2])
在名为HELIOS-A的随机、开放标签、全球性3期临床中,164名伴有多发性神经病(polyneuropathy)的hATTR淀粉样变性患者分别接受了vutrisiran或Onpattro的治疗。在接受治疗9个月后,与历史安慰剂组数据相比,vutrisiran组患者mNIS+7评分(评估神经病损伤的一种方式)的变化获得显著改善。评估生活质量,以及行走速度的指标也获得显著改善(p<0.001)。
辉瑞公司(Pfizer)近日宣布,其治疗杜氏肌营养不良(DMD)的在研基因疗法PF-06939926完成3期临床试验的首例患者给药。这一名为CIFFREO的3期临床试验预期在15个国家的55个临床试验中心入组99例4-7岁的非卧床男性患者。新闻稿指出,这是基因疗法治疗DMD患者的首个3期临床试验,对于这一患者群体来说是个重要的里程碑。

DMD是由于在X染色体上编码抗肌萎缩蛋白(dystrophin)的基因上出现突变而导致的罕见遗传病。抗肌萎缩蛋白的缺失或缺陷,导致肌肉在收缩过程中出现慢性损伤,炎症发作,影响肌肉的再生。最终,肌肉被瘢痕组织或者脂肪代替。患者的肌无力症状在2-3岁时就很明显,随着肌肉组织和功能的不断丢失,在12岁时通常只能靠轮椅行动,20岁时需要辅助呼吸,在30-40岁时因为呼吸或心力衰竭而早夭。
辉瑞公司开发的PF-06939926是一款在研静脉注射基因疗法。它将由人类肌肉特异性启动子控制的“迷你”抗肌萎缩蛋白(mini-dystrophin)转基因装在腺相关病毒9(AAV9)载体中。AAV9病毒载体具有向肌肉组织靶向递送转基因的能力。这款在研疗法已经被FDA授予孤儿药资格、罕见儿科疾病药物认定(rare pediatric disease designation)和快速通道资格。

图片来源:RF123
去年发布的1b期研究结果显示,9名6至12岁的DMD患者接受了PF-06939926的治疗。治疗12个月后,患者显示出持久和具有统计学意义的显著改善,包括微型抗肌萎缩蛋白表达的持续水平(使用液相色谱质谱法和免疫荧光染色法),以及NorthStar门诊评估量表(NSAA)得分的改善,这是一个经过验证的肌肉功能指标。
阿斯利康(AstraZeneca)宣布,其钠-葡萄糖协同转运蛋白-2(SGLT2)抑制剂达格列净(dapagliflozin)获得FDA授予的优先审评资格,用于治疗伴或不伴2型糖尿病(T2D)的新发或恶化慢性肾病(CKD)成人患者。阿斯利康表示,达格列净可能成为首个获批用于治疗慢性肾病患者的SGLT2抑制剂。

CKD是一种肾功能下降的严重疾病,影响全世界近8.5亿人口,且很多患者未被诊断。CKD患者表现之一为估计的肾小球滤过率(eGFR)降低,并至少持续3个月。CKD最常见的病因包括糖尿病、高血压和肾小球肾炎,通常与心脏病或卒中风险升高相关。CKD的最严重形式为终末期肾病(ESKD),大多数CKD患者在达到ESKD前将死于心血管疾病事件。阿斯利康新闻稿指出,CKD将成为全球第五大死亡原因。
达格列净是一种“first-in-class”的每日口服一次的SGLT2抑制剂。2020年10月,达格列净获得FDA授予突破性疗法认定,用于治疗CKD患者。达格列净在2014年获FDA批作为饮食和运动的辅助治疗,改善T2D成人患者的血糖控制;在2020年获批用于降低射血分数降低(HFrEF)心力衰竭成人患者的心血管死亡和因心力衰竭住院(hHF)风险。

本次优先审评资格的授予是基于名为DAPA-CKD的3期临床试验的证据。该试验表明,与安慰剂相比,达格列净在标准治疗基础上,可使慢性肾病2-4期患者的复合终点风险(包含肾功能恶化或心血管或肾性死亡风险)降低39%(p<0.0001)。与安慰剂相比,其还使全因死亡风险显著降低了31%(p=0.0035)。2020年3月,独立数据监测委员会根据对这一良好疗效的确定,建议提前停止试验。2020年8月DAPA-CKD试验详细结果发表在《新英格兰医学杂志》上。
Ribometrix公司近日宣布,与罗氏(Roche)旗下基因泰克(Genentech)公司开展战略合作,针对多个靶点发现和开发新型靶向RNA的小分子治疗药物。
RNA不但是传递DNA携带的遗传信息,指导蛋白质合成的关键“信使”,而且人体中的非编码RNA在多种不同疾病过程中也起到重要作用。除了使用RNAi和反义寡核苷酸(ASO)靶向RNA,使用小分子靶向RNA正在成为RNA靶向疗法开发的新兴热点。罗氏去年获得FDA批准治疗脊髓性肌萎缩症(SMA)患者的首款口服疗法Evrysdi(risdiplam),就是一款调节mRNA剪接的小分子调节剂。此前,罗氏已经与专注于开发靶向RNA的小分子疗法的Skyhawk Therapeutics公司和Arrakis Therapeutics公司达成研发合作,这一最新合作进一步拓展了罗氏在这一领域的布局。

Ribometrix具有RNA结构分析方面的专长。该公司的研究已经表明,许多与疾病有关的RNA含有适合与小分子结合的结构“口袋”。与当前基于蛋白质或RNA的靶向方法相比,靶向RNA的小分子药物可能在效力、选择性、口服生物利用度、组织分布和中枢神经系统渗透方面具有潜在优势。
根据合作协议,Ribometrix将应用其专有的发现平台,通过靶向RNA的3D结构来发现和优化调节RNA功能的小分子化合物。Ribometrix和基因泰克将合作进行小分子化合物的发现和临床前开发。基因泰克将负责进一步的开发和商业化,并获得针对多个预定靶标,在这一合作下发现的小分子化合物的研发和商业化的全球独家许可。Ribometrix将获得2500万美元的前期付款,并有资格获得超过10亿美元的潜在里程碑付款以及合作产生的未来产品的净销售额分成。

图片来源:Ribometrix公司官网
艾伯维(AbbVie)近日宣布,其IL-23抑制剂risankizumab在治疗中度至重度克罗恩病(Crohn's disease)成人患者的两项3期临床试验中,达到诱导研究阶段的主要终点。这是riisankizumab日前在治疗银屑病关节炎患者的3期临床试验中获得积极结果后再传捷报,体现了它在治疗多种炎症性疾病方面的潜力。

克罗恩病是一种慢性全身性疾病,表现为胃肠道内出现炎症,引起持续性腹泻、腹痛和直肠出血,并且会随着时间的推移而恶化。由于克罗恩病的症状难于预测,它给带病生活的人们带来身体、情感和经济上的重大负担。
Risankizumab(商品名Skyrizi)是一种IL-23抑制剂,通过与其p19亚基结合,特异性阻断IL-23。IL-23是一种参与炎症过程的细胞因子,被认为与许多慢性免疫介导的疾病有关。2019年4月,Skyrizi获得美国FDA批准,用于治疗适合接受全身治疗或光疗的中度至重度斑块状银屑病成人患者。
在名为ADVANCE和MOTIVATE的两项3期临床试验中,中重度克罗恩病患者接受了不同剂量的risankizumab的治疗。在ADVANCE研究中,根据克罗恩病活动指数(CDAI)评估,接受risankizumab(600 mg或1200 mg)治疗的患者在第12周达到临床缓解的比例显著提高(分别为45%和42%),安慰剂组患者这一数值为25%(p<0.001)。根据患者汇报结局指数PRO-2评估的临床缓解得到相似的结果。此外,在第12周,接受任一剂量risankizumab治疗的患者达到内镜缓解的比例也显著提高。 在MOTIVATE研究中,risankizumab也表现出类似的疗效。
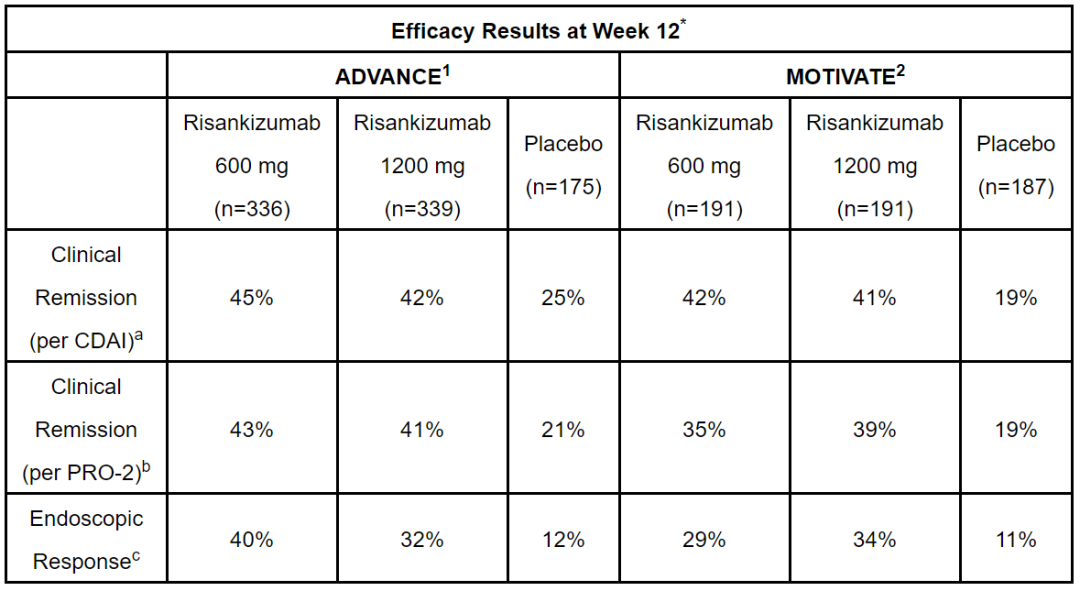
▲Risankizumab在两项3期临床试验中主要终点和次要终点的表现(图片来源:参考资料[6])
注:本文旨在介绍医药健康研究,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[3] Pfizer Doses First Participant in Phase 3 Study for Duchenne Muscular Dystrophy Investigational Gene Therapy. Retrieved January 7, 2021, from https://www.businesswire.com/news/home/20210107005031/en
[4] Farxiga granted Priority Review in the US for the treatment of patients with chronic kidney disease. Retrieved 2021-01-06, from https://www.astrazeneca.com/media-centre/press-releases/2021/farxiga-granted-us-priority-review-for-ckd.html
[5] Ribometrix Announces Collaboration with Genentech to Discover and Develop RNA-Targeted Small Molecule Therapeutics. Retrieved January 6, 2021, from https://www.ribometrix.com/rbx-new/genentech-collaboration/
[6] Risankizumab (SKYRIZI®) Demonstrates Significant Improvements in Clinical Remission and Endoscopic Response in Two Phase 3 Induction Studies in Patients with Crohn's Disease. Retrieved January 7, 2021, from https://www.prnewswire.com/news-releases/risankizumab-skyrizi-demonstrates-significant-improvements-in-clinical-remission-and-endoscopic-response-in-two-phase-3-induction-studies-in-patients-with-crohns-disease-301202802.html




 个人中心
个人中心
 我是园区
我是园区




