
胰腺癌,主要是胰腺导管腺癌 (PDAC),五年生存率低于10%,预计到2030年会成为癌症致死的第二大原因。胰腺癌的治疗方法非常有限。不幸的是,只有小部分PDAC患者的肿瘤为局部性且能被手术切除。化疗和放疗是胰腺癌治疗的常规方法,但几乎所有患者都会复发,二线治疗选择也非常少。
免疫检查点阻断 (ICB) 疗法,如抗PD-1、PD-L1或CTLA-4的单克隆抗体,可延长黑色素瘤、非小细胞肺癌或肾细胞癌等癌症患者的生存期。然而,除了部分微卫星不稳定性高的肿瘤患者(此类型患者在胰腺癌中不到1%)以外,针对免疫检查点受体或其同源配体的临床试验在胰腺癌中一直没有成功。典型的PDAC表现为免疫抑制肿瘤微环境,其特征是显著的髓系细胞浸润和缺乏有活性的细胞毒性T细胞。因此,寻找可能使PDAC肿瘤免疫微环境从“冷”向“热”转变的靶点,对于增强ICB治疗的有效性,从而延长胰腺癌病人生存期至关重要。
2021年12月6日,来自美国MD Anderson Cancer Center的马莉和洪明奇在Nature Communications上作为共同通讯作者发表了题为Glucocorticoid receptor regulates PD-L1 and MHC-I in pancreatic cancer cells to promote immune evasion and immunotherapy resistance 的研究论文,首次发现了糖皮质激素受体(glucocorticoid receptor,GR) 可作为胰腺癌细胞中PD-L1的转录激活因子和主要组织相容性复合体I类 (MHC-I) 的转录抑制因子。敲低或药物抑制GR可促进细胞毒性T细胞的浸润和活性,从而增强胰腺肿瘤对免疫检查点抑制剂的敏感性。

为了确定在胰腺肿瘤细胞里GR是否可以调控免疫相关的基因,作者使用了GR拮抗剂-米非司酮 (又称RU486;可用于治疗以糖皮质激素异常高水平为特征的库欣综合征患者) 处理细胞,以及通过shRNA敲低GR,发现PD-L1的表达显著减少而MHC-I信号通路相关基因表达显著增高,并且这一现象在多种雌性或雄性的人和鼠来源的胰腺癌细胞系中得到了验证。随后作者通过荧光素酶报告基因实验以及染色质免疫共沉淀的方法证明了GR通过转录调控增强PD-L1的表达以及抑制MHC-I相关基因的表达。
为了验证肿瘤细胞中的GR在体内的作用,作者使用了几种KPC (p48-Cre;KrasLSL-G12D/+ ;Trp53loxP/+)小鼠来源的胰腺癌细胞系(包括雄性和雌性),发现敲低或米非司酮抑制GR不改变癌细胞的体外增殖,也不影响癌细胞在免疫缺陷型小鼠体内的生长。但是,敲低或药物抑制GR 会显著抑制癌细胞在免疫功能正常的小鼠体内的生长,并且增加CD8+ T细胞的浸润和杀伤力,同时癌细胞PD-L1的表达减少,MHC-I的表达增加。当用CD8抗体清除细胞毒性T细胞或者敲低肿瘤MHC-I的表达后,靶向GR导致的肿瘤生长抑制的现象消失。那么,米非司酮和ICB的联合用药可否改善小鼠胰腺癌的免疫治疗效果呢?无论是雄性或雌性来源的PDAC 原位肿瘤,米非司酮和ICB的联合用药可显著抑制肿瘤的生长,延长小鼠生存时间。

米非司酮和ICB联合用药显著抑制胰腺肿瘤生长,延长生存时间
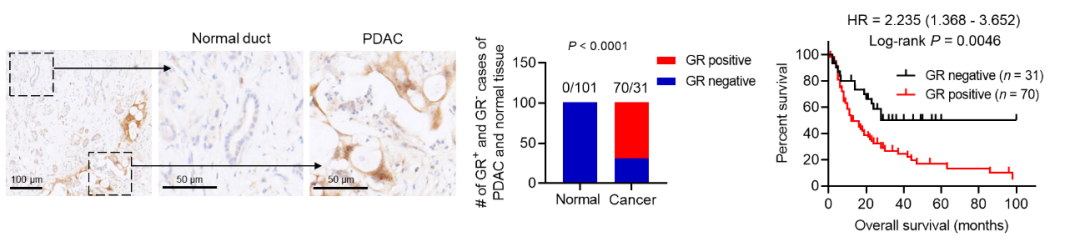
那么以上研究结论在人类胰腺癌病例中的相关性如何?通过对PDAC肿瘤组织芯片染色,作者发现胰腺癌中GR的表达显著高于正常的胰腺导管组织,并且GR表达高的病人的生存更差。IHC结果显示GR的表达和PD-L1的表达成正相关,和MHC-I和CD8的表达成负相关。有趣的是,作者发现PDAC病人血清中的皮质醇(GR的激动剂)水平显著升高,并且和PD-L1和GR成正相关,和MHC-I成负相关。总的来说,本文数据支持了GR信号激活和胰腺癌免疫逃逸之间的相关性。
根据本研究,GR可作为筛选标志物来决定哪些病人更适合这种联合治疗方法,GR表达高的病人有希望通过联合使用米非司酮和免疫治疗来改善免疫治疗效果和延长生存期。米非司酮是一种低毒性低成本的化合药物,早在1987年就开始在临床上使用。期待这个研究成果早日进入临床试验。
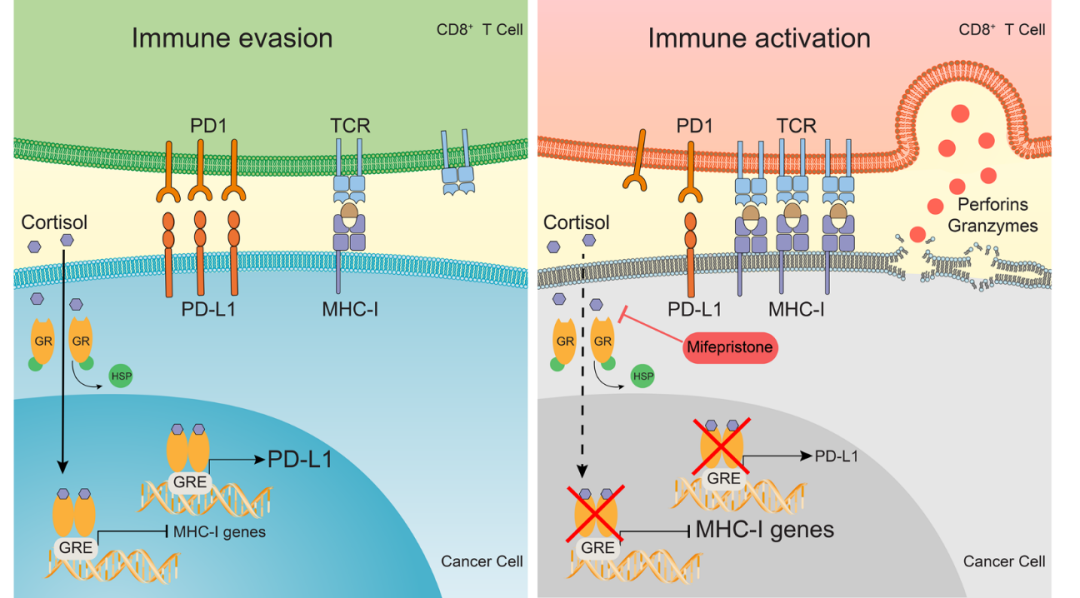
工作模式图
本研究的第一作者为MD Anderson Cancer Center的博士后邓雅岚,通讯作者为MD Anderson Cancer Center的马莉教授和China Medical University校长洪明奇院士(原MD Anderson Cancer Center vice president)。浙江省肿瘤医院为本研究提供了人群样本以及相关分析。
马莉(tenured full professor at MD Anderson)从事肿瘤转移和耐药性研究,last-author研究论文包括Nature Medicine, Nature Genetics, Nature Cell Biology (3), Nature Communications (4 + 1 in press)等,国际奖项包括AAAS Martin and Rose Wachtel Cancer Research Award (2014),AACR Stand Up To Cancer Innovative Research Award (2016), Metastasis Research Society Sue Eccles Award (2020) 等。实验室自2010年建立以来已培养了六名独立PI, 其中多人已经发表last-author研究论文,最近独立的姚帆博士即将有一篇Nature Communications一作及共通讯文章发表 (邓雅岚博士为共同一作)。欢迎加盟Yao Lab。

转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




