9月13日,百济神州宣布,FDA已受理其抗PD-1抗体药物百泽安(替雷利珠单抗注射液)的新药上市申请(BLA),用于治疗既往经系统治疗后不可切除、复发性局部晚期或转移性食管鳞状细胞癌(ESCC)患者。PDUFA目标日期为2022年7月12日。
至此,在美国国提交上市申请的国产PD-1达到4个,分别是:百济神州的替雷利珠单抗、信达生物的信迪利单抗、君实生物的特瑞普利单抗、康方生物的派安普利单抗。
2021年3月,君实生物宣布公司子公司TopAlliance Biosciences向FDA滚动提交了特瑞普利单抗(项目代号“TAB001/JS001”)用于治疗复发或转移性鼻咽癌的生物制品许可申请。
9月1日,君实生物宣布,公司子公司TopAlliance Biosciences已完成向FDA滚动提交关于特瑞普利单抗联合吉西他滨╱顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的生物制品许可。
特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤领域获得FDA授予2项突破性疗法认定、1项快速通道认定和3项孤儿药资格认定。
2021年5月18日, 信达生物和礼来制药共同宣布,FDA已经正式受理由双方共同合作研发的创新PD-1抑制剂药物信迪利单抗注射液联合培美曲塞和铂类用于非鳞状非小细胞肺癌(NSCLC)一线治疗的新药上市申请(BLA)。根据处方药用户付费法案(PDUFA),FDA对信迪利单抗的上市申请做出决议的目标日期是2022年3月。
2021年5月24日,康方生物宣布与中国生物制药有限公司共同开发的PD-1单抗药物派安普利单抗(研发代号:AK105)已经向美国食品药品监督管理局(FDA)启动提交生物制品许可申请,三线治疗转移性鼻咽癌。
特别值得指出的是,FDA对派安普利单抗的BLA审评使用了实时肿瘤审评(Real-Time Oncology Review, RTOR)的加快机制。这是中国首个在FDA的RTOR项目下进行BLA审评的PD-1药物。
公开资料显示,截止2020年4月,共有20个药物通过FDA的RTOR项目获得了批准,这些药物从申请提交到批准的平均时间为 3.3 个月,最快0.4个月,最慢5.9 个月。这意味着,通过RTOR项目的新药批准时间,将远远比过去的快速审评通道、突破性疗法或者孤儿药等方式,是FDA药物审评最快的通道。
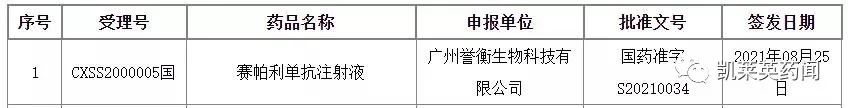
8月30日,NMPA 发布批件,誉衡生物的重组全源人抗 PD-1 单克隆抗体赛帕利单抗(GLS-010)获批上市,用于二线及以上复发或难治性经典型霍奇金淋巴瘤 (r/rcHL)。
至此,国内上市国产PD-1已多达6家,分别是恒瑞的卡瑞利珠单抗、百济神州的替雷利珠单抗、信达生物的信迪利单抗、君实生物的特瑞普利单抗、康方生物的派安普利单抗、誉衡生物赛帕利单抗。
而在出海方面,不同的企业采取不同的策略,但都有所进益,对外许可总金额超50亿美元。
本文为授权转载,版权归拥有者,仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。
欢迎朋友们批评指正!衷心感谢!
文中图片为授权正版图片,或来自微信公共图片库,或取自网络
根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
 点击这里,欣赏更多精彩内容!
点击这里,欣赏更多精彩内容!




 点击这里,欣赏更多精彩内容!
点击这里,欣赏更多精彩内容!
 药选址
药选址





 点击这里,欣赏更多精彩内容!
点击这里,欣赏更多精彩内容!