IPO详解 | Talaris:诱导器官移植后持久免疫耐受的细胞疗法公司今晚上市
收藏
关键词:
IPO上市移植器官免疫细胞疗法
资讯来源:蹊之美股生物医药 + 订阅账号
发布时间:
2021-05-07
微信公众号:蹊之美股生物医药 / CaesarBiotech
标的公司: Talaris Therapeutics(NASDAQ:TALS)
根据Talaris Therapeutics最新提交的IPO招股书,公司将发行882万股,发行价约在$16-$18,总募资额约1.72-1.8亿美元。公司将于今晚在纳斯达克上市交易。

IPO前持股>5%的机构包括Blackstone,Longitude Venture,Qiming Venture(启明创投)等:
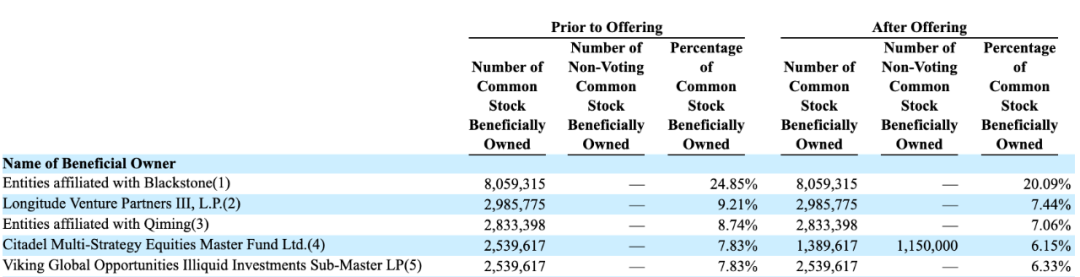
2018年11月-2020年8月,A轮融资,经过首轮、二轮和三轮封闭后,共融资7500万美元,分别由Clarus Lifesciences和Blackstone领投,Longitude Venture和Qiming Venture均跟投。
2020年9月,B轮融资1.15亿美元,Viking Global Opportunities Illiquid Investments和Citadel Multi-Strategy Equities Master Fund领投,Blackstone,Longitude Venture和Qiming Venture跟投。
Talaris Therapeutics是一家临床后期阶段细胞治疗公司,于2002年成立。公司专有的同种异体造血干细胞疗法(Facilitated Allo-HSCT Therapy),可以诱导接受了不匹配/无血缘关系的器官移植患者的耐受性,避免出现器官排异,摆脱长期抗排异药物的使用。
在实体器官移植中,所有接受同种异体移植的受者,都要面临移植排斥的问题。通过寻找HLA(人类白细胞抗原)配型较高的供体,可一定程度降低免疫排斥的风险,但受体患者仍需终身服用免疫抑制药物,以避免排异。排异指的是受者免疫系统会将移植物识别为异体组织并攻击它,接受含有免疫细胞的器官移植还可能出现移植物抗宿主(GvHD)。
长期大量的服用免疫抑制药物,除了药物经济负担,患者依从性降低导致不良预后,还会带来多种并发症,包括发展为移植物丢失、癌症(肾移植患者中25%死于癌症)、心血管疾病、感染、代谢异常和神经紊乱等。
2、Facilitated Allo-HSCT诱导嵌合和同种异体耐受性
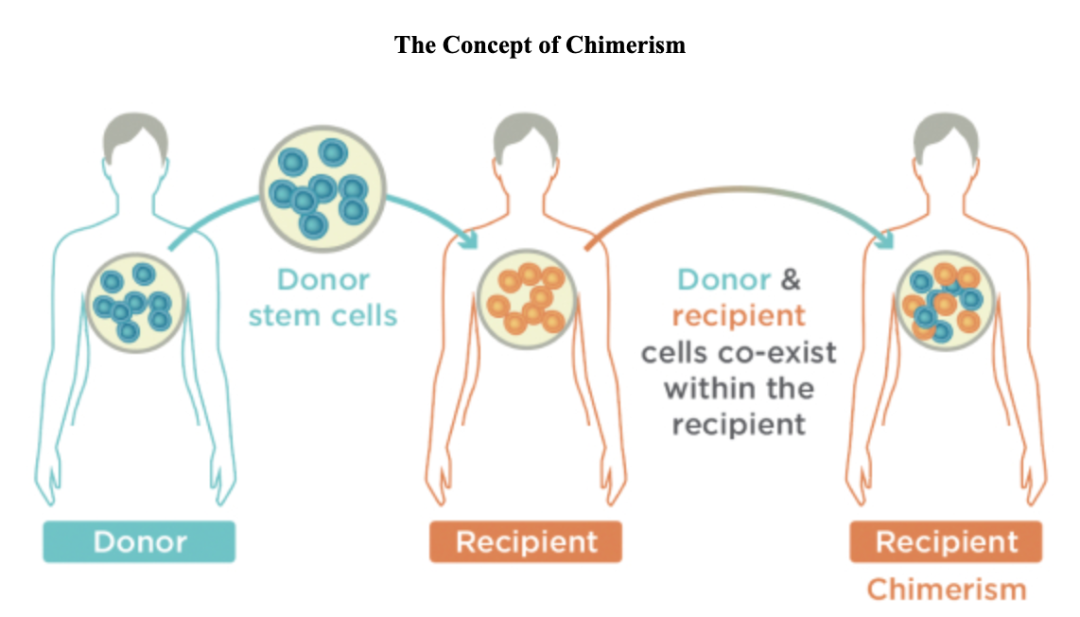
公司相信通过其专有细胞疗法诱导同种异体耐受性,在实体器官移植、严重自体免疫疾病等具有治疗潜力,而嵌合体是诱导持久同种异体耐受性的最有效方法。
嵌合现象(chimerism),指供体的HSC(造血干细胞)与受者的HSC并存于受者的骨髓中的状态,这种共存的HSC反之产生来源于受体和供体的血细胞和免疫细胞。同种异体耐受性(Allogeneic tolerance),是指受体先前存在的免疫系统,和供体移植的免疫系统(在接受同种异体造血干细胞移植后共存)在体内互相识别对方的细胞和组织为“自体”(Self)的嵌合状态。
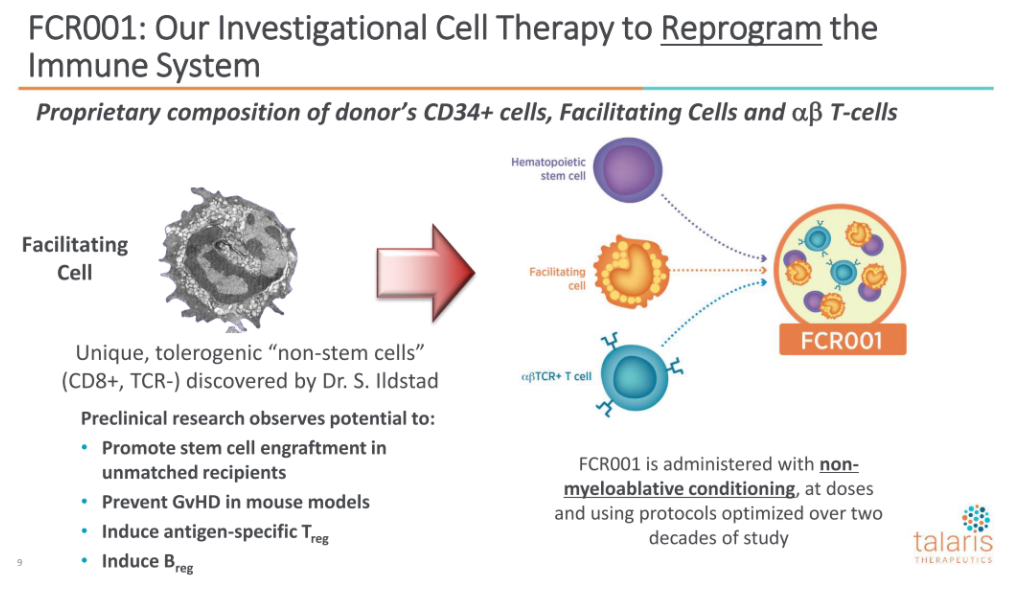
3、公司主要在研Allo-HSCT疗法 FCR001
公司主要在研Allo-HSCT疗法FCR001是专有、单次使用、来自供体外周血细胞的细胞疗法,指征活体肾移植(LDKT)、LDKT延迟耐受诱导和皮肤硬化症等,所有指征使用的FCR001完全一致。
FCR001是来源于供体外周血,数量经过优化的3种细胞组成:
1)移植供体的HSCs作为祖细胞,重建受体的造血和免疫系统;
2)Facilitating Cells(FCs)指的是在细胞表面表达CD8蛋白,且没有功能性T细胞受体的混合细胞群,负责快速有效地植入供体HSC来促进嵌合体;
3)aßTCR+ T-cells用以支持非清髓条件下,供体HSC在受体的植入,该细胞会增加急性GvHD的风险,FCR001的aßTCR+ T-cells数量经过优化,促进植入的同时减少GvHD风险。
这3种细胞中,Facilitating Cells被认为是降低了异体移植GvHD的关键。
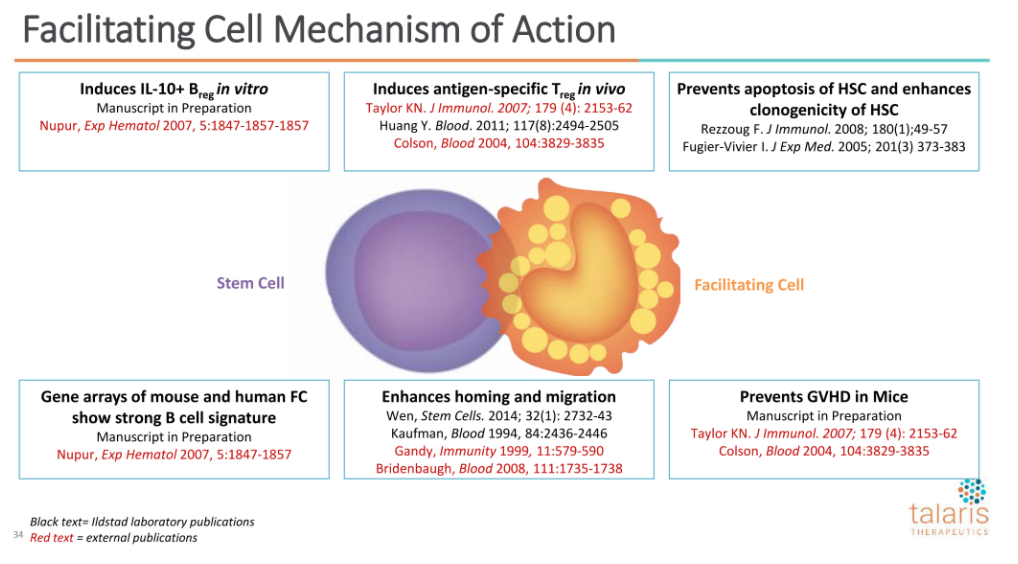
在临床前,公司和之前的合作伙伴诺华,评估了FC对致命照射小鼠中HSC植入的影响。观察到单独移植5000HSCs会造成移植失败死亡,然而5000的HSCs和30000FCs的移植则让所有小鼠存活,为FC的使用提供了MOA(作用机理),公司认为这也是为什么在2期临床中,HLA错配程度高但GvHD事件发生率低的原因。
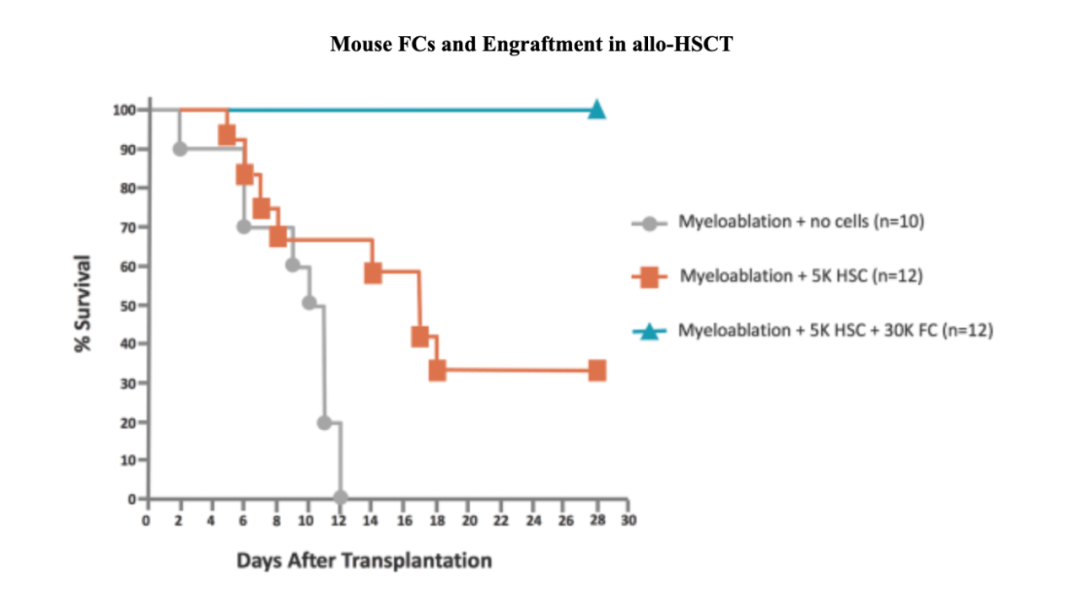
该细胞疗法由公司自己的GMP细胞处理设备生产,时间在24小时内,关键的细胞处理步骤没有外包。与基因疗法或CAR-T相比不需要使用病毒载体,转导或体外细胞扩增。此外,目前公司正在研究是否可从已故器官供体获得的骨髓中生产FCR001。(即FCR002)
基本流程是在计划移植前3周,肾移植供体服用药物,使其干细胞和免疫细胞从骨髓中循环到血液。通过特定单采程序,采集干细胞和免疫细胞,运输至公司GMP细胞处理设备。移除一定数量的aßTCR+ T-cells,使供体的HSC和FCs相对更丰富。每次FCR001的HSC和FC的最小剂量根据患者情况而定,aßTCR+ T-cells的目标剂量范围也是。成品将会被冷冻保存,经过处理后回到移植中心储存。
根据此前的临床2期数据,FCR001已被美国FDA授予该指征的孤儿药和再生医学高级治疗(RMAT)。
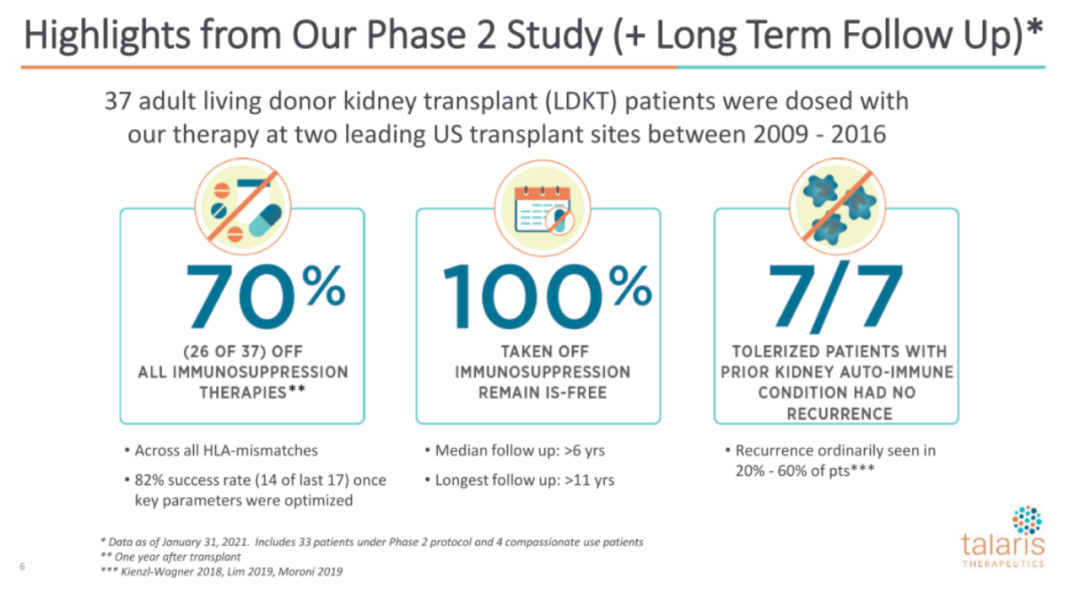
在该临床2期研究中,37例LDKT患者在2009年-2016年接受了FCR001治疗,将持续随访15年。供者和受者的配对为年龄在18至65岁之间,且符合试验资格标准的成年人,允许供体和受体之间所有水平的免疫HLA不匹配。患者移植后第二天输注FCR001,6个月后评估嵌合体情况,出现嵌合体的受试者在1年内逐渐减量抗排异药物,1年后停药。
截止2021年1月31日,37例患者的中位随访时间为6年,33例患者随访至少超过36个月,21例患者随访超过60个月,目前患者情况如下:
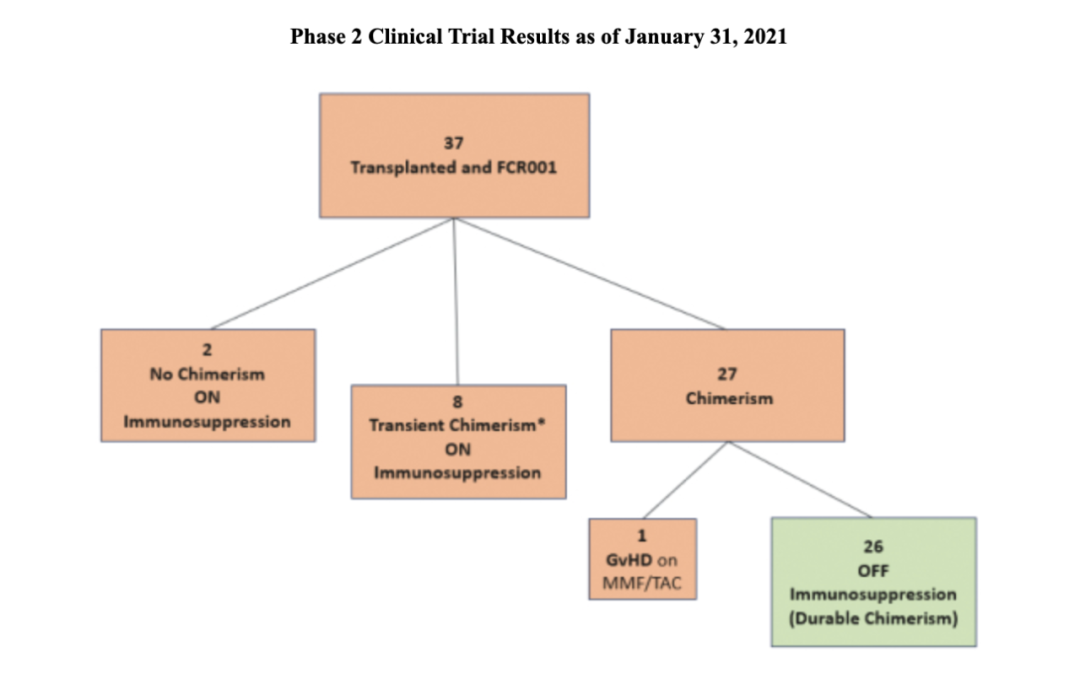
26例患者取得持久供体嵌合(定义为移植后六个月的全血或T细胞供体嵌合率大于40%),并成功地摆脱了长期免疫抑制药物,且没有发生急性排斥反应或供体特异性抗体。2例未出现嵌合体、保持长期免疫抑制的患者分别因肺炎球菌败血症和肺癌,于移植后3.5年和4年时死亡。
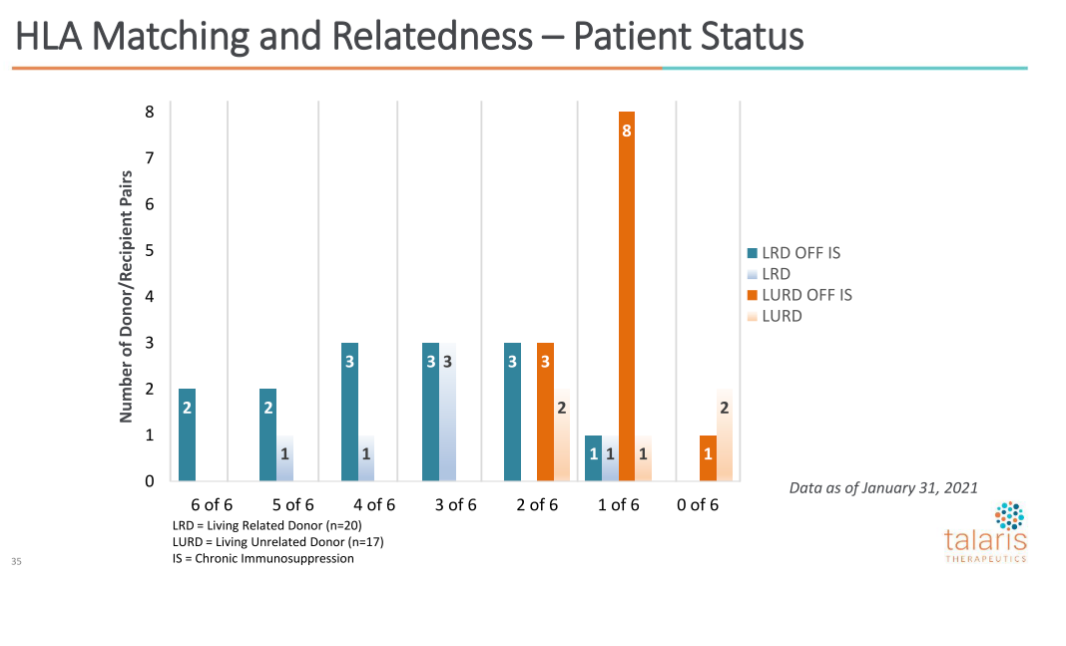
在不同HLA抗原匹配水平上,都观察到了停用免疫抑制。下图为37例患者HLA匹配程度:
移植后5年的总生存率为92%(34/37),3例移植物丢失发生在未建立持久嵌合体并且不能中断慢性免疫抑制的患者中。
试验的PI对受试者移植后5年的肾功能通过eGFR(肾小球滤过率)进行了回溯性分析,与标准治疗对比,FCR001保留了肾功能,降低了高血压和高血脂药物的使用:
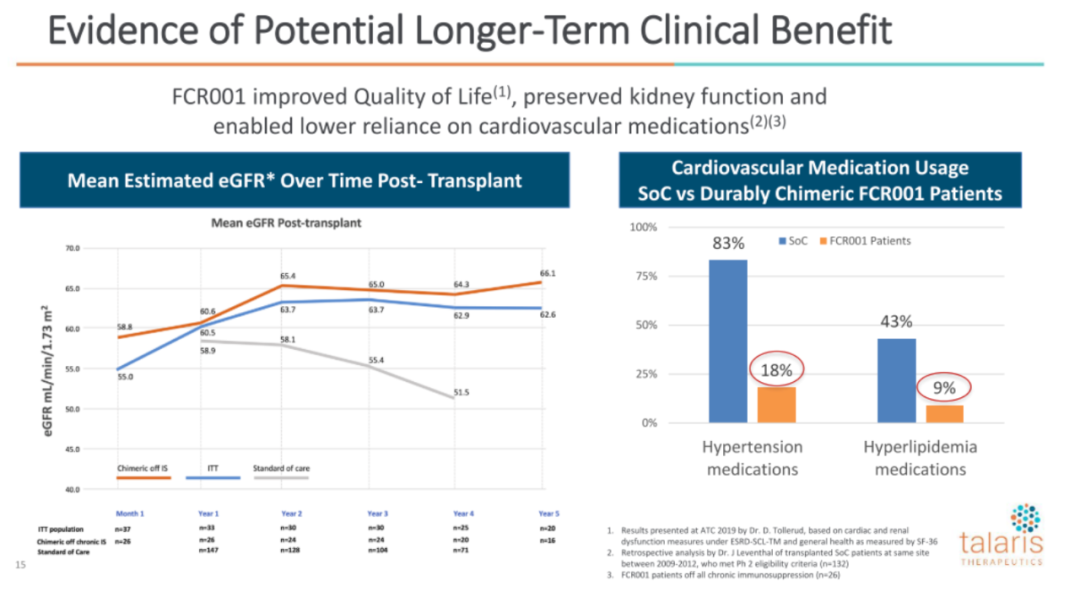
此外,公司相信持久免疫耐受是可通过移植后嵌合体情况进行预测的,因为在第3个月和第6个月出现嵌合体的患者,几乎都有持久免疫耐受性并不再服用免疫抑制药物:(公司在路演中强调这是他们认为最重要的一张片子)
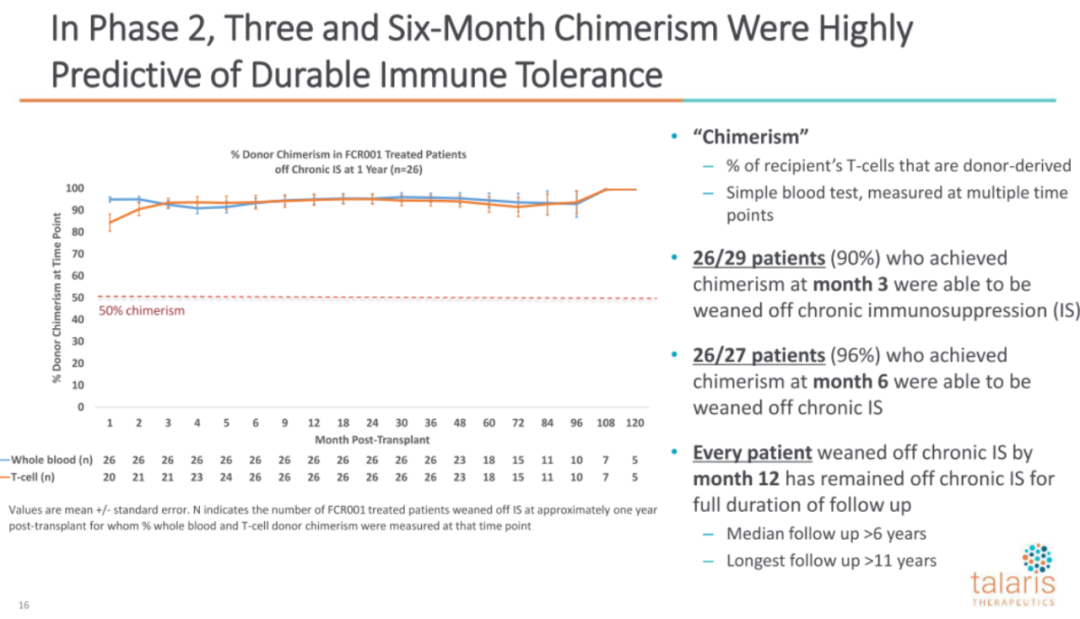
在该临床2期研究中,最常见的不良反应是腹泻,BK病毒血症,发烧,咳嗽和恶心。最常见严重不良事件为发烧,深静脉血栓。
3例死亡分别为3级移植物抗宿主病(GvHD)伴复发性巨细胞病毒性肠炎、肺癌、肺炎球菌败血症和人间质肺炎病毒感染(未遵从试验方案在国外旅游时获得)。
2例GvHD发生,均为女性供体配对无血缘关系男性受体病例,虽然研究中类似配对病例均未发生GvHD,但3期临床中将会排除类似配对。
6例患者被诊断出患有皮肤癌(鳞状细胞癌和基底细胞癌),均得到治疗。在实体器官移植中,皮肤癌占恶性肿瘤的40%至50%。
3.3.2 肾移植3期临床试验FREEDOM-1正在进行,Q4公布初步数据
FCR001的主要指征活体肾移植(LDKT),目前正在美国进行5年期的随机、多中心、开放标签3期临床研究FREEDOM-1,该注册性临床试验旨在评估FCR001在接受活体肾移植患者上的安全性和疗效。
120例受试者将按2:1随机进入治疗组或对照组,3期临床试验的设计和2期临床大体相同,但对最低细胞剂量进行调整,并排除了几个2期临床中发现的可能引起嵌合失败或GvHD的因素,研究将排除群反应抗体数(PRA)大于20%,近期进行过输血,女性供体配对无血缘关系男性受体等对干细胞移植高度敏感的患者。
患者将在肾移植第二天输注FCR001,公司将评估在肾移植术后1年内,逐渐降低抗排异药物剂量至不使用药物免疫抑制情况下,FCR001诱导持久免疫耐受的潜力。3期临床的初步数据预计在2021年Q4公布。下图为患者治疗流程:
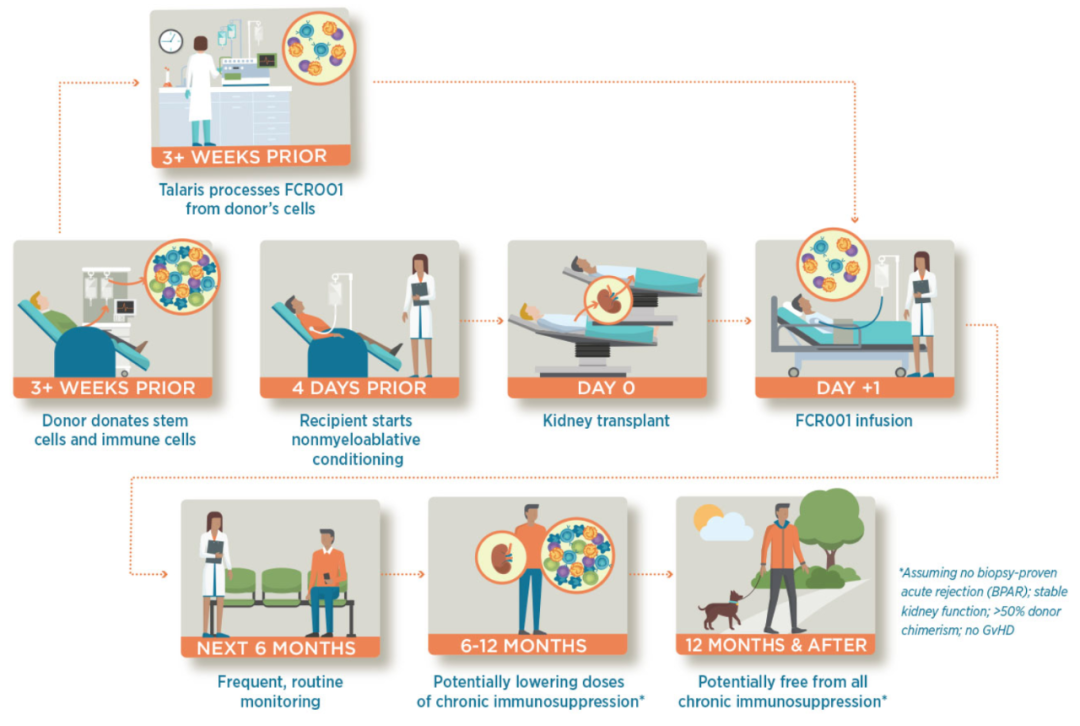
在计划移植前3周,从供体采血送回工厂处理,冷冻保存好送回移植中心。在移植前4天,受体接受非清髓性的低剂量化疗和1次辐照,可在门诊完成,主要是为了免疫抑制,通常即使捐献的HSC不能植入,患者的免疫系统也可自行恢复。在移植前3天使用免疫抑制药物预防术后排异和GvHD,术后第一天接受FCR001的单次输注。
术后6个月接受标准免疫抑制疗法,并在第6个月进行评估,如出现持久的捐赠者嵌合体(定义为至少50%的供体T细胞嵌合),没有出现GvHD,肾功能保持稳定,可以停药MMF(霉酚酸吗啉乙酯,一种嘌呤代谢抑制剂)。他克莫司可在第9个月减量,如果持续满足推进条件,他克莫司可在第12个月停药。
此外公司计划在2021年下半年,重开针对肾移植后1年患者诱导延迟耐受的FREEDOM-2研究,在为期五年的多中心、单臂、开放标签试验中,评估FCR001细胞治疗在已接受LDKT1年后患者中的安全性,初步疗效和总体获益。
除了器官移植,FCR001也将在自身免疫疾病进行临床试验:
公司IP、潜在监管和技术壁垒以及First mover advantages:



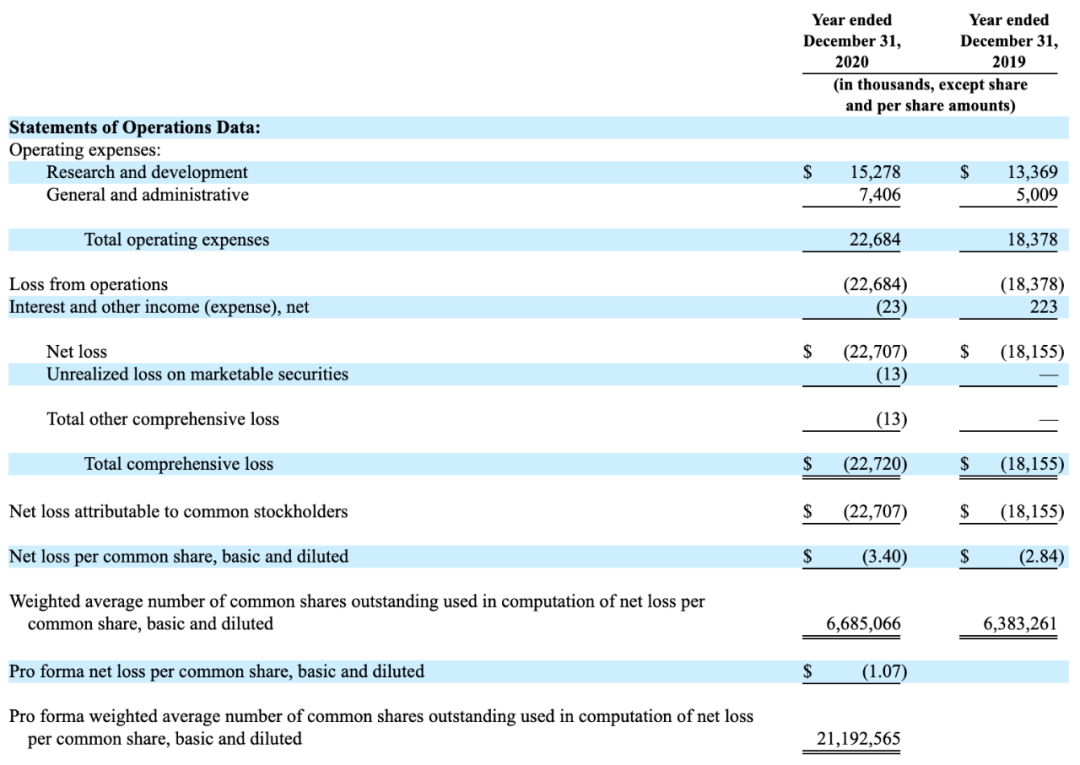
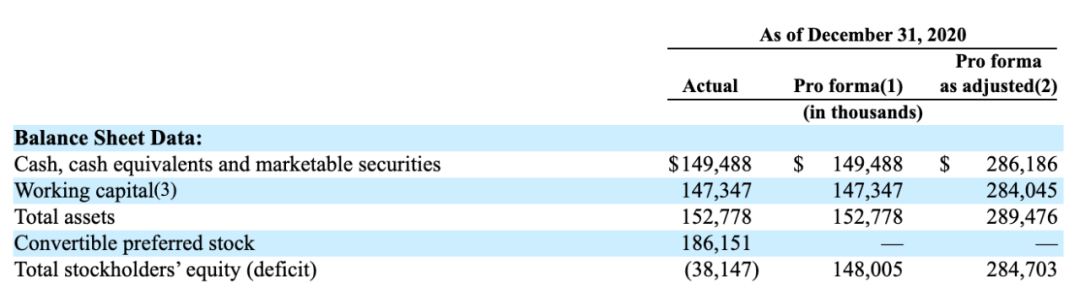
现金$149M(As of December 31, 2020),IPO后现金约2.86亿美元。
追踪和剖析全球最前沿生物科技公司,寻找低估值/革命性的生物科技产品或技术平台,深入挖掘其投资价值。
联系方式:CaesarBiotech@aliyun.com





















 个人中心
个人中心
 我是园区
我是园区




