
责编 | 兮
温室气体一氧化二氮(N2O)对气候变化的影响和对臭氧层的消耗在过去的一百年间稳步增长,其主要来源为工业过程的副产品和农业中含氮化肥的大规模使用。作为惰性气体,N2O在大气中可稳定存在114年,使其全球变暖潜能值(global warming potential)为二氧化碳(CO2)的300倍。目前已知自然界中只有一种酶可将其还原为无害的氮气和水,即一氧化二氮还原酶(nitrous oxide reductase, N2OR)。该酶是一种含铜离子和硫化物的金属酶,对氧气敏感,其生物合成及组装过程一直尚未明晰。
2022年7月27日,德国弗莱堡大学化学与药学学院生物化学研究所Oliver Einsle团队与美国Van Andel研究所杜鹃/吕伟团队在Nature杂志上发表题为 Molecular interplay of an assembly machinery for nitrous oxide reductase(一氧化二氮还原酶组装过程的分子相互作用)的研究论文。该工作结合生物化学与结构生物学手段,解析了多个参与一氧化二氮还原酶成熟组装过程的膜蛋白复合体结构,详细地绘制了这一复杂过程的各个步骤。

N2OR的结构基因为nosZ,位于一个保守的nosRZDFYL基因簇中。之前研究已表明在生理条件的铜离子浓度下,N2OR的成熟组装需要ABC转运蛋白NosDFY和铜分子伴侣蛋白NosL的参与。研究团队首先在大肠杆菌中表达和分离了来源于假单胞菌的NosDFY转运蛋白(图1),该复合体处于打开状态;当引入ATP结合关键位点突变E154Q并结合ATP后,复合体处于关闭状态;两种状态下,亚基NosD分别处于两种构象。
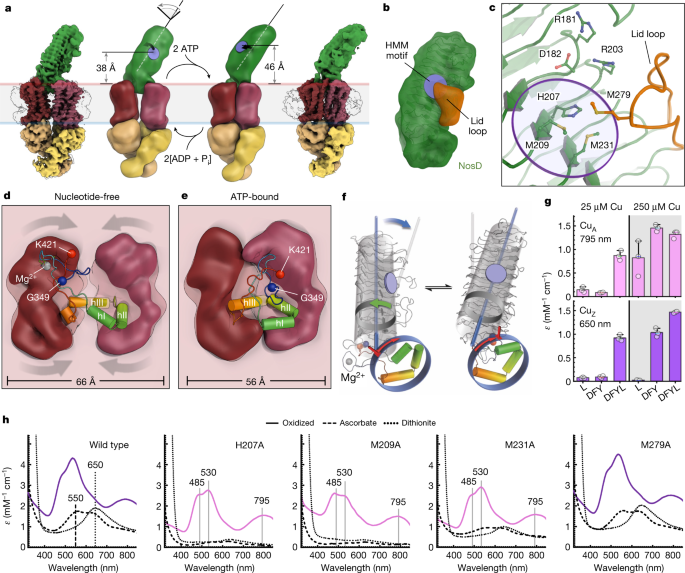
图1 ABC转运蛋白的打开及关闭状态,以及亚基NosD表面的铜离子结合位点
研究团队进一步发现当NosDFY处于打开状态时,能与铜离子分子伴侣蛋白NosL结合形成NosDFYL复合体,实现铜离子从NosL到NosD的传递(图2)。而当NosDFY处于关闭状态时,因为亚基NosD发生了构象变化,只能与NosZ结合形成NosZDFY复合体,从而实现铜离子的进一步传递(图3)。
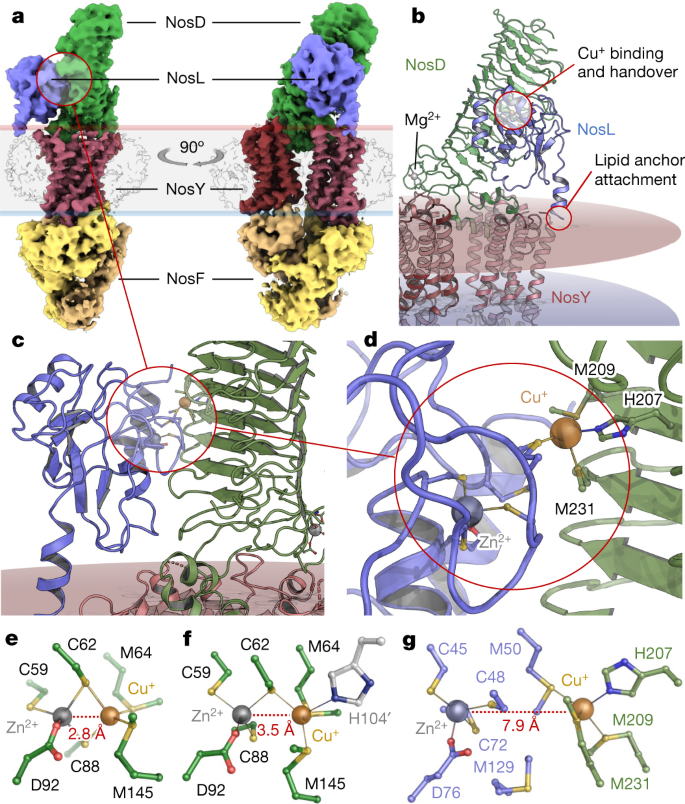
图2 未结合ATP的NosDFY从分子伴侣NosL获得一价铜离子
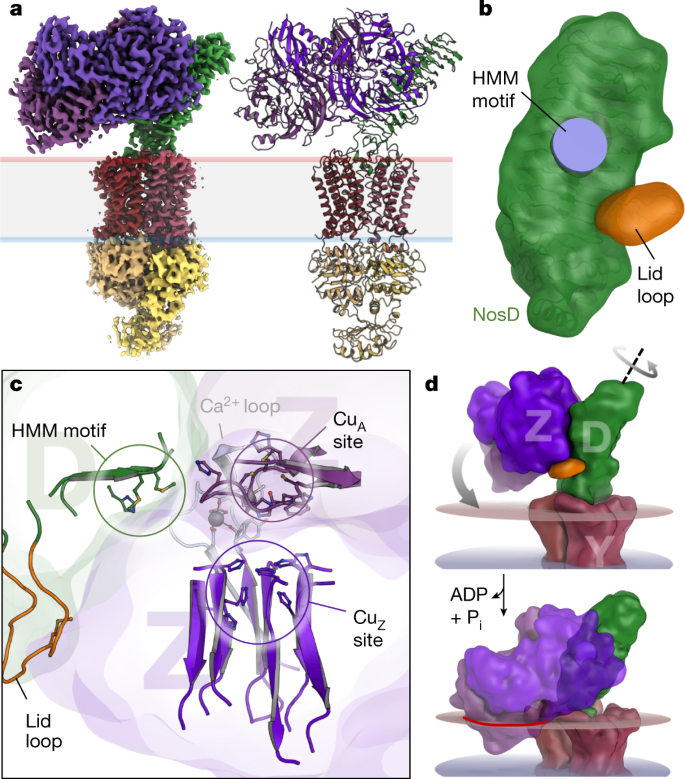
图3 结合ATP状态的NosDFY与NosZ形成复合体
基于多个复合体的结构信息,研究团队得以绘制一个相对清晰的铜离子传递途径:当转运蛋白NosDFY处于打开状态时,亚基NosD可与NosL结合,并在其表面的金属离子结合位点HMM获得一价铜离子;亚基NosF结合ATP后,转运蛋白处于关闭状态,亚基NosD发生构象变化使得NosL从复合体解离,而一氧化二氮还原酶的apo蛋白二聚体NosZ此时可与亚基NosD结合而获得铜离子;ATP水解再次使得NosDFY处于打开状态,亚基NosD也再次发生构象变化从而释放NosZ。此循环重复六次之后,可完成一个二铜中心(CuA)和一个四铜二硫(CuZ)活性中心的组装。
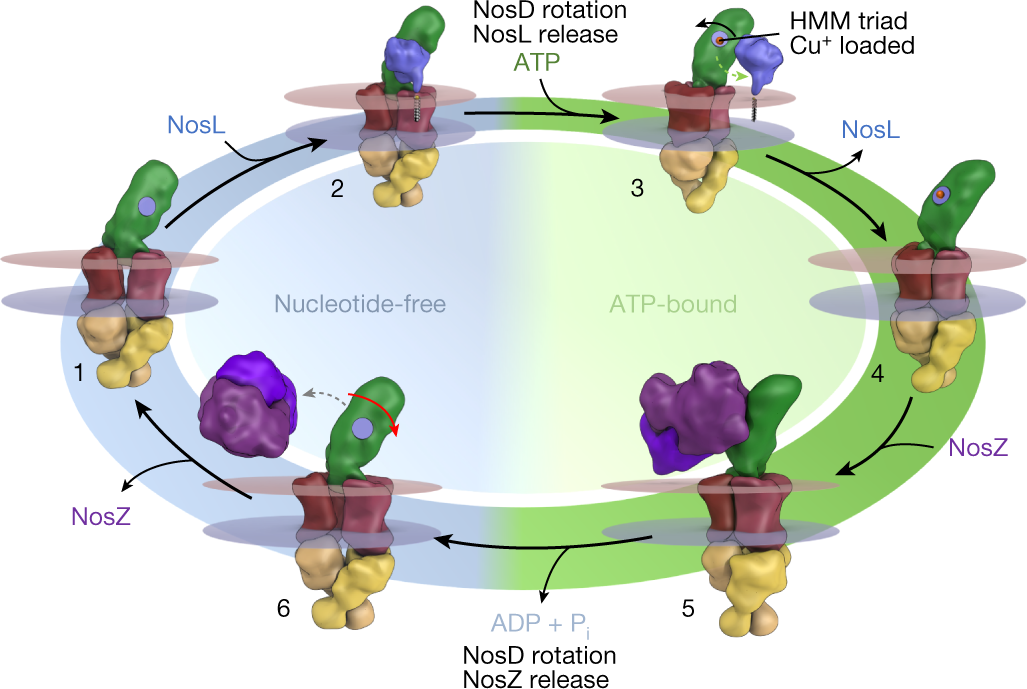
图4 铜离子由NosL通过NosDFY传递到NosZ的模型
该项工作利用多个高分辨率的结构模型,详细地绘制和解析了这一复杂过程的各个步骤。并发现了ABC转运蛋白家族以前未曾被描述过的功能,即实现胞内化学能到周质空间机械能的转换,而非转运特定的底物。该项研究也向N2O还原酶体系的工程化改造以期减少大气中的N2O含量迈出了重要一步。
德国弗莱堡大学Christoph Müller博士和张霖(Lin Zhang)博士为该论文的共同第一作者,美国Van Andel研究所杜鹃(Juan Du)教授和德国弗莱堡大学Oliver Einsle教授为共同通讯作者。
Oliver Einsle教授是德国弗莱堡大学化学和药学学院生物化学研究所所长,2020被选为德国科学院(Leopoldina)院士。他和他的团队长期研究复杂酶系统的结构功能及生物合成。他们的工作重点是氮气、一氧化二氮或一氧化碳等小分子的酶促活化,这些小分子由于其化学稳定性而难以转化,但同时又具有重要的生态和经济意义。
原文链接:
https://doi.org/10.1038/s41586-022-05015-2
制版人:十一
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




