1类新药获批上市——林普利塞片为滤泡性淋巴瘤患者提供新的治疗方案
收藏
关键词:
瘤淋巴新药患者治疗上市获批药
资讯来源:药事纵横 + 订阅账号
发布时间:
2022-11-14
2022年11月9日中国国家药品监督管理局(NMPA)批准了上海璎黎药业有限公司领衔研发的抗癌1类创新药林普利塞片(商品名:因他瑞)上市。因他瑞为我国自主研发并拥有自主知识产权的创新药,适用于既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤(follicularlymphoma,FL)成人患者[1]。
淋巴瘤是起源于淋巴造血系统的恶性肿瘤,主要表现为无痛性淋巴结肿大,肝脾肿大,全身各组织器官均可受累,伴发热、盗汗、消瘦、瘙痒等全身症状。淋巴瘤根据瘤细胞种类分为非霍奇金淋巴瘤(non-Hodgkinlymphoma,NHL)和霍奇金淋巴瘤(Hodgkinlymphoma,HL)两类。
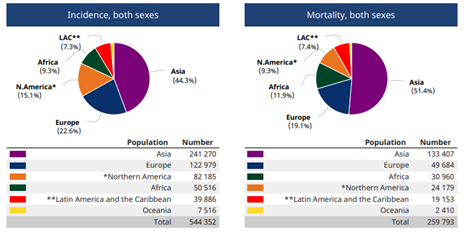
世界卫生组织GLOBOCAN2020显示2020年全球新发霍奇金淋巴瘤(HL)83087例,其中男性48981例,女性34106例;死亡23376例,其中男性14288例,女性9088例。2020年全球新发非霍奇金淋巴瘤(NHL)544352例,其中男性304151例,女性240201例;死亡259793例,其中男性147217例,女性112576例[2]。
淋巴瘤是中国最常见的恶性肿瘤之一。世界卫生组织GLOBOCAN2020显示2020年中国新发霍奇金淋巴瘤(HL)6829例,其中男性4506例,女性2323例;死亡2807例,其中男性1865例,女性942例。2020年中国新发非霍奇金淋巴瘤(NHL)92834例,其中男性50125例,女性42709例;死亡54351例,其中男性29721例,女性24630例;男性NHL发病率和死亡率均居全部恶性肿瘤第10位;女性NHL发病率和死亡率均未进入全部恶性肿瘤的前10位[2]。
滤泡性淋巴瘤(FL)是一种起源于滤泡生发中心的惰性非霍奇金淋巴瘤。在我国FL约占NHL的8.1%〜23.5%,中位发病年龄55〜60岁,发病率女性略高于男性。该病呈惰性进展,中位生存期可达10年余,但大部分疾病最终会出现复发或转化,且目前仍不能被治愈。
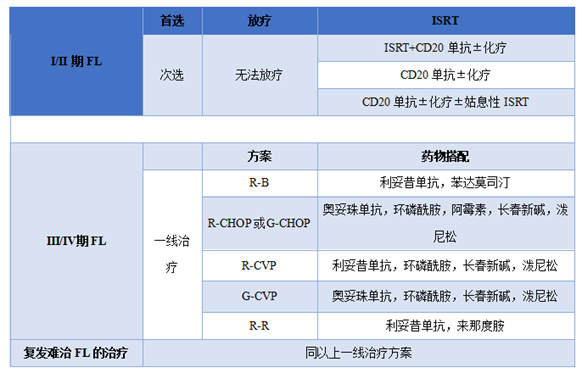
淋巴瘤病理类型复杂,治疗原则各有不同,进一步提高淋巴瘤的诊疗能力和规范化实施,保障抗肿瘤药品的供应十分重要。
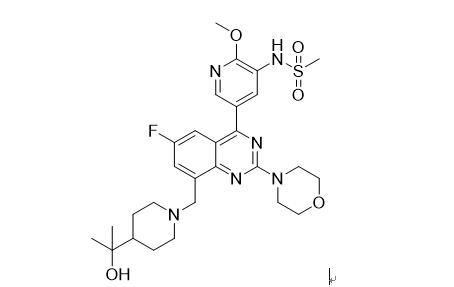
林普利塞为新一代磷脂酰肌醇-3-激酶的δ亚型(PI3Kδ)选择性抑制剂,林普利塞片可抑制PI3Kδ蛋白的表达,降低AKT蛋白磷酸化水平,从而诱导细胞凋亡以及抑制恶性B细胞和原发肿瘤细胞的增殖。
PI3Kδ在细胞增殖和存活中起着关键作用,因而成为了淋巴瘤的有效靶点。PI3Kδ主要表达于免疫细胞和造血细胞中,参与B细胞中BCR的信号传导,控制机体内B细胞的发育和成熟过程。当有抗原刺激机体时,BCR表面的特异性免疫球蛋白与抗原结合,导致ITAM磷酸化,磷酸化的ITAM能够募集并激活SYK,活化的SYK能激活PI3Kδ,促使生成PIP3,生成的PIP3能够与BTK的N端结构域识别,并与之相互作用,介导BTK向膜上募集,从而激活BTK介导的B细胞信号传导,诱导众多相关基因的表达[4]。
另外,磷酸化的CD19也能募集细胞膜上PI3Kδ,从而激活PI3Kδ,催化PIP2生成PIP3,促使AKT活化,调控细胞增殖、迁移、凋亡等过程。
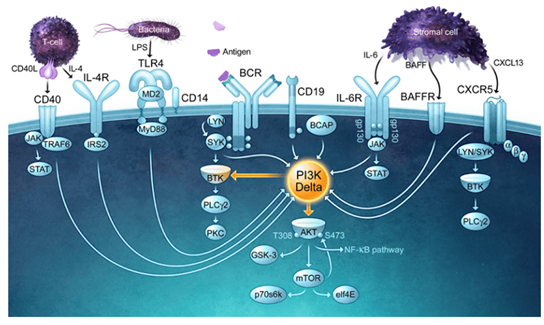
已有研究表明,抑制PI3Kδ对治疗血液肿瘤有效,因此PI3Kδ激酶成为治疗血液肿瘤例如:慢性淋巴细胞白血病(CLL)、非霍奇金淋巴瘤(NHL)、霍奇金淋巴瘤(HL)、套细胞淋巴瘤(MCL)等及其相关肿瘤的一个理想靶点。
2019年4月29日,上海璎黎药业有限公司在中国开始了一项林普利塞治疗复发和/或难治滤泡性淋巴瘤患者的单臂、开放、多中心II期临床试验,目的是探究林普利塞对于滤泡性淋巴瘤患者的安全性和有效性。本次临床试验已于2021年3月29日初步完成。

该次临床试验的试验结果最近一次公开报道是2022年5月12日,在欧洲血液学协会第27届大会上,试验结果表明,针对意向治疗人群,林普利塞在有效性和安全性方面均取得了统计和临床意义的提高[6]。
成果一:林普利塞治疗复发/难治滤泡性淋巴瘤有效性高
林普利塞在复发/难治滤泡性淋巴瘤受试者中表现出显著的临床益处。独立数据评估(根据淋巴瘤疗效评价标准IRWG评估)结果显示:林普利塞在89例(可评估病例)复发/难治滤泡性淋巴瘤的患者中,客观缓解率(ORR)达80%以上,疾病控制率(DCR)达95%以上。
从统计结果分析来看,林普利塞口服给药安全可控、耐受性好。恶心等常见的胃肠道不良反应和同类药物特别关注不良反应如腹泻、肝毒性等发生率低于同靶点药物文献报道。与传统疗法相比,林普利塞并未发现呕吐、脱发、静脉炎、心脏毒性等副反应,且极少导致全血细胞重度减少,服药过程一般不需要住院监测,携带方便,大大的提升了患者的生活质量。
目前共有13项林普利塞临床试验在中国和全球范围内开展。已完成和正在进行中的临床试验有:
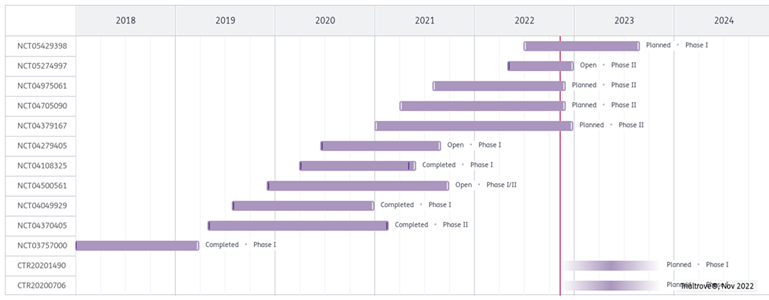
图6 林普利塞在中国和全球范围内开展的临床试验[7]
NCT05429398:林普利塞联合Camrelizumab治疗晚期实体瘤患者的单臂、开放、多中心I期临床研究。(中国,目标入组118人,实际暂未入组)
NCT05274997:评估林普利塞单药治疗复发/难治性外周T/NK细胞淋巴瘤患者的疗效和安全性的单臂II期临床研究。(意大利;美国,目标入组97人,实际暂未入组)
NCT04975061:林普利塞治疗复发/难治性胸腺疾病患者的2期临床研究。(中国,目标入组58人,实际暂未入组)
NCT04705090:调查林普利塞对复发/难治性外周T/NK细胞淋巴瘤患者的疗效和安全性的单臂、开放、多中心II期临床研究。(中国,目标入组90人,实际暂未入组)
NCT04379167:一项评估林普利塞对至少两次系统治疗失败的复发/难治性滤泡性非霍奇金淋巴瘤患者的疗效、安全性、耐受性和药代动力学的单臂II期临床研究。(中国,目标入组140人,实际暂未入组)
NCT04279405:林普利塞治疗复发和/或难治性B细胞恶性血液肿瘤患者的 Ib 期临床研究。(中国,目标入组80人,实际暂未入组)
NCT04108325 :林普利塞用于复发或难治性外围T细胞淋巴瘤患者的单臂、开放、多中心Ib期临床研究。(中国,目标入组58人,实际入组43人)
NCT04500561:林普利塞联合GEMOX治疗复发和/或难治弥漫大B细胞性淋巴瘤患者的单臂、开放式、多中心Ib/II期临床试验。(中国,目标入组28人,实际暂未入组)
NCT04049929:林普利塞对晚期实体瘤患者的单臂、开放、多中心、I期临床研究。(中国,目标入组50人,实际入组78人)
NCT04370405:评估林普利塞对复发/难治性滤泡性非霍奇金淋巴瘤受试者的安全性和有效性的单臂、开放II期临床研究。(中国,目标入组123人,实际入组93人)
NCT03757000:口服林普利塞治疗复发/难治性B细胞恶性血液肿瘤患者的I期临床研究。(中国,目标入组42人,实际入组25人)
CTR20201490:评价高脂高热饮食对健康志愿者单次口服林普利塞片药物代谢动力学影响的单中心、随机、开放、2序列、2周期的临床研究。(中国, 目标入组14人,实际暂未入组)
CTR20200706:林普利塞在中国成年男性健康志愿者体内的物质平衡与生物转化I期临床试验。(中国, 目标入组6人,实际暂未入组)
上海璎黎药业有限公司是一家科技创新型生物医药企业。本着“研发国内一流、国际领先的创新药物”研发理念,致力于临床未满足药物的研发并专注于研发用于癌症、自身免疫性疾病和代谢性疾病治疗的具有自主知识产权的化学小分子创新药物。
随着新医改的不断深入,中国医药行业也逐渐从仿制向创新转型,创新药的黄金时代已然到来,坚持自主研发,坚持自主创新是当前各大药企高质量长远发展的有力保障。目前璎黎药业研发的抗肿瘤新药林普利塞片的获批上市不仅为滤泡性淋巴瘤患者带来福音,为人民身体健康作出璎黎药业贡献,也为中国创新药发展注入了新的动力。
[1]NMPA官网:国家药监局附条件批准林普利塞片上市(nmpa.gov.cn)
[2]CANCER TODAY官网: Cancer Today (iarc.fr)
[3]中国抗癌协会淋巴瘤专业委员会, 中华医学会血液学分会. 中国滤泡性淋巴瘤诊断与治疗指南(2020年版)[J]. 中华血液学杂志 2020年41卷7期, 537-544页, MEDLINE ISTIC PKU CSCD CA, 2020.
[4]辛敏行, 张三奇. 选择性PI3Kδ抑制剂的研究进展[J]. 中国药科大学学报, 2016(47):503-510.
[5]Front Immunol. 2012, Aug 23; 3:256
[6]上海璎黎药业有限公司官网:璎黎药业 (yl-pharma.com)









 药选址
药选址






